-
(14分)某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2 + 2NaOH=== NaNO3 + NaNO2 + H2O
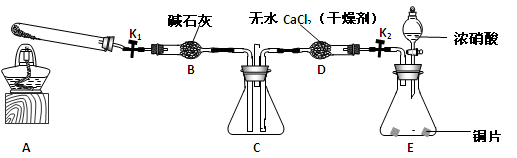
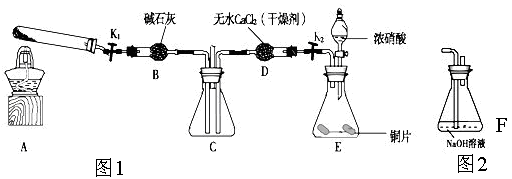
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
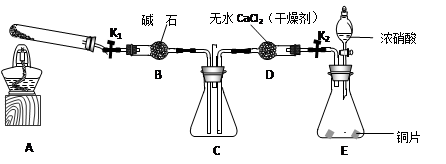
(1)E装置中制取NO2反应的化学方程式是________。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是________。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③________。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验。
①装置的合理连接顺序是(某些装置可以重复使用)________。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________。
-
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O
利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
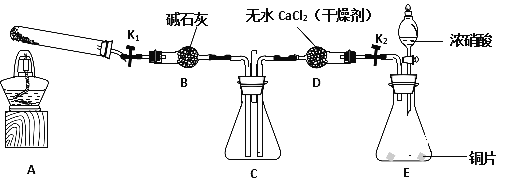
(1)E装置中制取NO2反应的化学方程式是________________________________。
(2)制取氨气时若只用一种试剂,从下列固体物质中选取___________
a.NH4HCO3 b.NH4C1 c.Ca(OH)2 d.NaOH
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是____________________。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
① NH3还原性较弱,不能将NO2还原;② 在此条件下,NO2的转化率极低;
③_______________________________________
(5)此实验装置存在一个明显的缺陷是________________________
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如右图所示),重新组装,进行实验。

① 装置的合理连接顺序是 _____________
② 实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为____________________。
-
某化学课外活动小组通过实验探究NO2的性质。已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2均为止水夹,夹持装置已略去)。
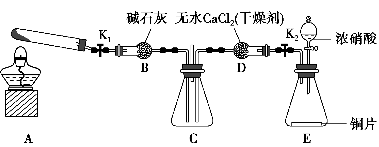
(1)E装置中制取NO2的化学反应方程式是____________________________
____________________________________________。
(2)若NO2能够被NH3还原,预期在C装置中观察到的现象是________________________________________________________________。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为有以下三种可能:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______________________________________________________________。
(4)此实验装置中一个明显的缺陷是__________________________________。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:________________________________________________________。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换成Na2O2,另选F装置(如图所示),重新组装进行实验。
①装置的合理连接顺序是(某些装置可以重复使用)________。
②实验过程中,B装置中的粉末由淡黄色逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中发生反应的化学方程式为__________________________________
-
(15分)某化学课外活动小组通过实验研究NO2的性质:(已知:2NO2+2NaOH = NaNO3+NaNO2+H2O)
任务1:利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)E装置中制取NO2反应的离子方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

①装置的合理连接顺序是(某些装置可以重复使用) 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。
-
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
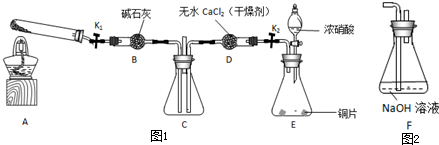
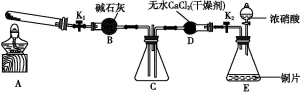
任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是______.
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是______.
(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______.
(4)此实验装置存在一个明显的缺陷是______.
任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:______.
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)______.
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为______.
-
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O

任务1:利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).
(1)E装置中制取NO2反应的化学方程式是______.
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是______.
(3)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______.
(4)此实验装置存在一个明显的缺陷是______.
任务2:探究NO2能否与Na2O2发生氧化还原反应.
(5)实验前,该小组同学提出三种假设.
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3:______.
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
①装置的合理连接顺序是(某些装置可以重复使用)______.
②实验过程中,B装置中淡黄色粉末逐渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为______.
-
某化学课外活动小组通过实验研究NO2的性质,已知:2NO2+2NaOH=NaNO2+NaNO3+H2O 利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
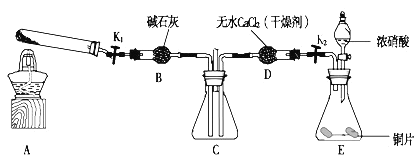
(1)E装置中制取NO2反应的离子方程式是______。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取______ 。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是______。
(4)实验过程中,未能观察到C装置中的预期现象,该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③______ 。
(5)此实验装置存在一个明显的缺陷是 ______。
(6)探究NO2能否与Na2O2发生氧化还原反应,为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。

装置的合理连接顺序是 ______,实验过程中,B装置中淡黄色粉末逐 渐变成白色,经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为 ______。
-
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)
(1)E装置中制取NO2反应的离子方程式是________。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取________。
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是________。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③________。
(5)此实验装置存在一个明显的缺陷是________。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
-
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去).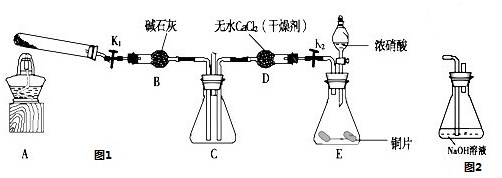
(1)E装置中制取NO2反应的离子方程式是________.
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取________
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是________.
(4)实验过程中,未能观察到C装置中的预期现象.该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③________.
(5)此实验装置存在一个明显的缺陷是________.
(6)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.
装置的合理连接顺序是________.实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为________.
-
某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH NaNO3+NaNO2+H2O
NaNO3+NaNO2+H2O
任务1:利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(1)E装置中制取NO2反应的化学方程式是 。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是 。
(3)实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;
②在此条件下,NO2的转化率极低;
③ 。
(4)此实验装置存在一个明显的缺陷是 。
任务2:探究NO2能否与Na2O2发生氧化还原反应。
(5)实验前,该小组同学提出三种假设。
假设1:二者不反应;
假设2:NO2能被Na2O2氧化;
假设3: 。
(6)为了验证假设2,该小组同学选用任务1中的B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图所示),重新组装,进行实验。
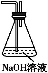
①装置的合理连接顺序是 。
②实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为 。














