-
[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
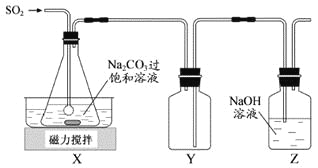
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为_________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
-
[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
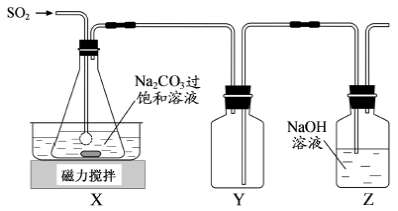
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
-
[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
-
[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
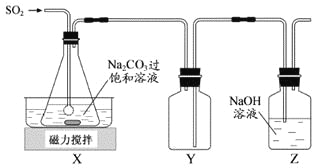
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
-
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
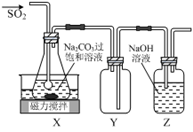
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为_____________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
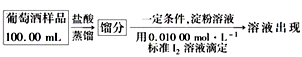
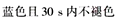
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
-
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
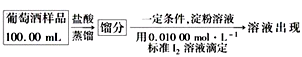
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
-
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是 。
-
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为4NaHSO3=2Na2S2O5+2H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是___________。
(3)实验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4,其可能的原因是_____。
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

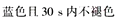
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
-
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
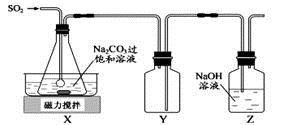
当溶液pH约为4时,停止反应。在20℃静置结晶,生成Na2S2O5的化学方程式为2NaHSO3=2Na2S2O5+H2O。
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为 。
(2)装置Y的作用是 。
(3)析出固体的反应液经减压抽滤,洗涤,25℃-30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、 和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体,用饱和SO2水溶液洗涤的目的是 。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是 。
-
焦亚硫酸钠(Na2S2O5)是一种常用的食品抗氧化剂(易被氧化)。实验室利用如图所示装置制取少量焦亚硫 酸钠,并探究 SO2 的性质 (夹持装置已略去)。

请回答下列问题:(实验前已除去装置中的空气)
(1)仪器 a 的名称是_____。
(2)关闭 K2、K3,打开 K1,装置 B 中发生反应的离子方程式为_________,观察到装 置 C 中发生的现象是_____。
(3)装置 D 和 F 的作用是____。
(4)实验前,E 中所用蒸馏水需经煮沸后迅速冷却,目的是_____, 关闭 K1、K3,打开 K2,一段时间后 E 中有 Na2S2O5 晶体析出,装置 E 中发生反应的化学方程式为__________________。
(5)设计实验验证 Na2S2O5 晶体在空气中已被氧化,所需试剂为_____。
(6)在测定某葡萄酒中Na2S2O5 残留量时,取 40.00 mL 葡萄酒样品,加入指示剂,用 0.01000 mol·L−1 的碘标准液滴 定,当溶液_________,即为终点。测定实验中,消耗碘标准液 10.00 mL,该样品中Na2S2O5的残留量为_____g·L−1(以 SO2 计)。