-
氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
| 物质 | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
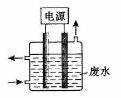
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000mol•L-1H2SO4,用0.0200 mol•L-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。
-
氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄露需要及时处理。
(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,则向NaCN溶液中通入少量CO2,发生反应的离子方程式是________。
(2)若氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式 _____________;
②已知:氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3=NaSCN+Na2SO3,当1.96gNaCN完全反应时转移的电子物质的量是__________;实验室中硫氰化钠可以代替硫氰化钾检验______________。
(3)现要检测某经过处理过的废水中氰化钠的含量。已知:废水中氰化钠最高排放标准是0.50mg/L;Ag++2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓,CN—优先与Ag+反应。
实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;用1.00×10—4mol·L—1的标准AgNO3溶液滴定,达到滴定终点时,消耗AgNO3溶液的体积为1.50mL。(假设废水中没有其它成分参与反应。)
①滴定达到终点时的现象是____________________________________;
②该废水________(填“能”或“不能”)直接排放到河流中,通过计算结果说明得出上述结论的依据:____________________。
-
氰化钠,白色结晶颗粒或粉末,易潮解,剧毒,水溶液显弱碱性,化学式为NaCN,熔点为563.1℃,是一种重要的化工原料,多用于化学合成,电镀冶金等方面。其制备工艺如下:
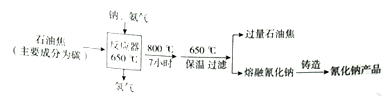
(1)制备过程的化学反应方程式为____________________________________。
(2)工厂中,氰化钠存储区应贴的标志为________(填选项字母)。

(3)已知NaCN中碳、氮原子均满足8电子稳定结构,其电子式为_____________。
(4)丙烯氨氧化法制丙烯腈的过程中有大量副产物HCN,HCN被NaOH溶液吸收,也是制备NaCN的一种重要方法。含等物质的量的NaCN和HCN的混合溶液,其pH>7,该溶液中下列关系式一定正确的是________(填选项字母)。
A.2c(Na+)=c(CN-) B.c(CN-)<c(HCN)
C.c(H+)=c(OH-)-c(HCN) D.c(Na+)-c(CN-) =c(OH-)-c(H+)
已知25℃时,HCN的电离平衡常数Ka=4.9×10-10,则该温度下NaCN的水解平衡常数Kb=________(结果保留到小数点后一位)。
(5)泄露的含NaCN的溶液可用双氧水处理,生成一种常见的酸式盐和一种常见的碱性气体,化学方程式为__________________________________。
(6)某废水样品中主要含有CN-和Cl-,若用电解法除去废水中的CN-,装置如图所示,控制废水的pH范围在9~10,阳极产生的ClO-可将CN-氧化为N2和CO32-,阳极的电极反应式为________。 除去CN-的离子反应方程式为____________________________。

-
氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面。NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下:
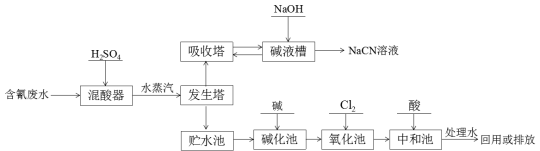
已知:HCNO的结构式是:H-O-C≡N
HCN的Ka = 6.02×10-10
[Ag(CN)2]-(aq)  Ag+(aq) + 2CN-(aq) K = 1.3×10-21
Ag+(aq) + 2CN-(aq) K = 1.3×10-21
回答下列问题:
(1)CN-中两原子均为8电子稳定结构,请写出CN-的电子式_____________________。
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式 。
(3)向发生塔中通水蒸汽的目的是 。
(4)氧化池中氰化物的降解分两步进行
CN-被氯气氧化成低毒的CNO- ,写出相应的离子方程式 ,
CNO-被氯气氧化成无毒的两种气体,写出相应的离子方程式
(5)贮水池中废水须先经碱化后再进行氧化的原因___________________________。
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密。电解液使用Na[Ag(CN)2],请写出阴极反应式 ,解释工业电镀中使用氰离子(CN-)的原因 。
-
氰化钠(NaCN)是一种重要化工原料,用于化学合成、电镀、冶金等方面。NaCN有剧毒,含氰废水需经无害化处理才能排放,某电镀厂含氰废水的一种工业处理流程如下: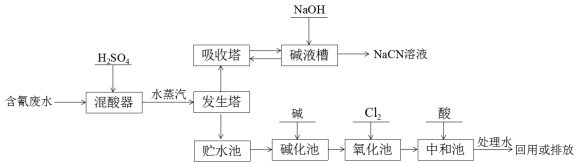
已知:HCNO的结构式是:H-O-C≡N
HCN的Ka= 6.02×10-10
[Ag(CN)2]-(aq) Ag+(aq) + 2CN-(aq) K = 1.3×10-21
Ag+(aq) + 2CN-(aq) K = 1.3×10-21
回答下列问题:
(1)CN-中两原子均为8电子稳定结构,请写出CN-的电子式_______________。
(2)氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式_______________。
(3)向发生塔中通水蒸汽的目的是____________。
(4)氧化池中氰化物的降解分两步进行
CN-被氯气氧化成低毒的CNO- ,写出相应的离子方程式____________________,
CNO-被氯气氧化成无毒的两种气体,写出相应的离子方程式________________。
(5)贮水池中废水须先经碱化后再进行氧化的原因_______________________。
(6)电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密。电解液使用Na[Ag(CN)2],请写出阴极反应式 ,解释工业电镀中使用氰离子(CN-)的原因 。
-
氰化钠 是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
是重要的化工原料,易溶于水,易水解生成氰化氢,剧毒物质。常用于电镀、冶金、有机合成医药、络合剂和掩蔽剂。
 装氰化钠
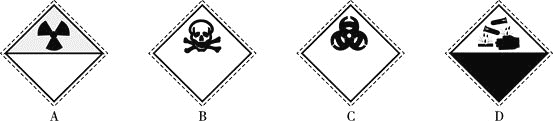
装氰化钠 试剂瓶的标签上应印有下列警示标记中的________
试剂瓶的标签上应印有下列警示标记中的________ 填序号
填序号 。
。
 实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
实验室用NaCN固体配制NaCN溶液时,为避免其水解,应先将其溶于______________浓溶液,再用蒸馏水稀释。
 泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
泄漏时用双氧水处理以减轻环境污染,处理后生成一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的离子方程式是__________________________________________。
 化学兴趣小组利用:2NH
化学兴趣小组利用:2NH 反应原理制备NaCN并检测其纯度。
反应原理制备NaCN并检测其纯度。
实验一:制备NaCN装置如图所示
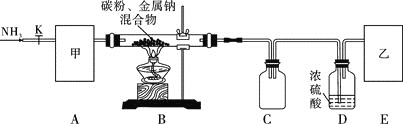
 装置C的作用是____________。甲可选取下列装置中的________
装置C的作用是____________。甲可选取下列装置中的________ 填序号
填序号 。
。

 安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________
安装好实验仪器,检查装置气密性,取一定量的碳粉与金属钠混合,放入硬质玻璃管内;接下来的操作正确的是________ 填序号
填序号 。
。
A.先打开活塞K,缓缓通入一段时间氨气后再加热硬质玻璃管
B.先加热硬质玻璃管,再打开活塞K,缓缓通入氨气
C.打开活塞K,一边缓缓通入氨气,同时加热硬质玻璃管
 上述装置中乙处还需补充的实验仪器或装置有__________________。
上述装置中乙处还需补充的实验仪器或装置有__________________。
实验二:测定产品中氰化钠的含量
 已知: Ag
已知: Ag ,Ag
,Ag ,AgI呈黄色,且CN
,AgI呈黄色,且CN 优先与Ag
优先与Ag 反应。取制备好的产品
反应。取制备好的产品 ,配成
,配成 溶液,取
溶液,取 于锥形瓶中,并滴加
于锥形瓶中,并滴加 滴KI溶液作指示剂,用
滴KI溶液作指示剂,用 的标准AgNO
的标准AgNO 溶液滴定3次,平均消耗AgNO
溶液滴定3次,平均消耗AgNO 溶液的体积为
溶液的体积为 。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________
。滴定终点的现象是____________________________________________________________,产品氰化钠的纯度为________ 。
。
-
氰化钠(NaCN)是一种重要化工原料,常用于化学合成、电镀、冶金等方面。氰化钠也是一种无机毒害品,本身不易燃,但遇潮湿空气或与酸类接触会产生剧毒、易燃的氰化氢气体,与氯酸盐、硝酸盐等接触会剧烈反应,引起燃烧爆炸。近几年,我国屡屡出现因氰化钠的生产和储存不当,造成火灾、爆炸等事故。请结合所学知识,回答下列问题:
(1)氰化钠中N的化合价为_, CN-中两原子均为8电子稳定结构,请写出CN-的电子式__。
(2)工业上可用纯碱、焦炭、氨气在高温下反应制取NaCN,请写出该反应的化学方程式:______________。
(3)常见的处理氰化钠的方法有:
① 将其与双氧水反应转化为两种溶于水都呈碱性的物质;
② 将其用ClO2处理,得到无毒的NaCl、N2和CO2。
方法①的离子方程式为__________。
用方法②处理含NaCN 4×10-5mol/L的废水1O00L,至少需要ClO2的质量为_____g。
(4)若pKa =-lg{Ka},已知常温下HCN的pKa=9.21,浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”、“碱”或“中”)性,通过计算说明其原因___________。
-
氰化钠 ,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
,白色结晶颗粒或粉末,易潮解,应用于合成、电镀、冶金、药物等多个领域,是一种重要的基本化工原料.
 氰化钠中含有化学键的类型为______
氰化钠中含有化学键的类型为______ 碳的化合价为______价,据此推测,氰化钠中碳可能表现的性质是______
碳的化合价为______价,据此推测,氰化钠中碳可能表现的性质是______ 填序号
填序号 ;
;
 只具有氧化性
只具有氧化性  只具有还原性
只具有还原性  既有氧化性又有还原性
既有氧化性又有还原性
工业上生产氰化钠的方程式为: 该反应的还原剂为:______
该反应的还原剂为:______ 填化学式
填化学式 ,当反应得到
,当反应得到 氰化钠时,转移电子数为______,同时产生标况下氢气______L;
氰化钠时,转移电子数为______,同时产生标况下氢气______L;
 氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性
氰化钠遇水时极易与水反应,产生一种具有挥发性的可燃物,最终所得溶液呈强碱性 强于同条件等浓度的碳酸氢钠溶液
强于同条件等浓度的碳酸氢钠溶液 ,写出相关的离子方程式______,溶液中各离子浓度由大到小的顺序为______
,写出相关的离子方程式______,溶液中各离子浓度由大到小的顺序为______ 配制氰化钠溶液的方法是______
配制氰化钠溶液的方法是______ 填序号
填序号 ;
;
 在通风橱中,直接将其溶解于水
在通风橱中,直接将其溶解于水
 在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
在通风橱中,先将其溶解于氢氧化钠溶液,再稀释到相应浓度
 在通风橱中,边通
在通风橱中,边通 边将其溶解于水
边将其溶解于水
 时向等体积
时向等体积 的氢氧化钠溶液和
的氢氧化钠溶液和 的氰化钠溶液中不断滴加同浓度的稀盐酸至
的氰化钠溶液中不断滴加同浓度的稀盐酸至 ,消耗盐酸的体积前者______后者
,消耗盐酸的体积前者______后者 填“大于”、“等于”或“小于”
填“大于”、“等于”或“小于” ;
;
 氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物
氰化钠可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物 ,其反应方程式为:
,其反应方程式为: ,
, 在水溶液中的电离方程式为:
在水溶液中的电离方程式为: 然后再用锌从溶液中把金置换出来,锌转化为
然后再用锌从溶液中把金置换出来,锌转化为 据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:______;负极:______;
据此,请写出在空气中用氰化钠溶液提取金的电极反应式:正极:______;负极:______;
 含氰化钠的废水可以在碱性条件下,加入
含氰化钠的废水可以在碱性条件下,加入 或通入
或通入 ______
______ 填常用试剂名称
填常用试剂名称 处理,使
处理,使 转变为无危害的气体.若人不慎氰化钠中毒,可用
转变为无危害的气体.若人不慎氰化钠中毒,可用 缓解,二者反应得到两种含硫元素的离子,其中一种遇到
缓解,二者反应得到两种含硫元素的离子,其中一种遇到 可变为血红色.写出解毒原理相关离子方程式______.
可变为血红色.写出解毒原理相关离子方程式______.
-
NaCN(氰化钠)有毒,是一种重要的基础化工原料,可用于化学合成、电镀、冶金等。下列说法不正确的是
A. NaCN中含有的化学键类型为离子键和极性键
B. NaCN 中碳元素显+4 价
C. NaCN 与过量过氧化氢反应时有NH3生成,在该反应中,NH3既不是氧化产物又不是还原产物
D. 实验室配制NaCN 溶液时,先将NaCN 固体溶解在较浓的NaOH 溶液中,再加水稀释
-
NaCN(氰化钠)是一种重要的基础化工原料,可用于电镀、冶金和有机合成等。回答下列问题。
(1)NaCN溶液中发生水解反应的离子方程式为_______________________________,实验室配制NaCN溶液的方法是______________________________。
(2)NaCN与Cl2反应可制备ClCN(氯氰),氯氰的电子式为_________。
(3)制备NaCN的方法很多种。
①氨钠法:反应原理为2Na+2C+2NH3 2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
2NaCN+3H2。该反应中,每生成1molNaCN,转移电子的物质的量为_________。
②NaCN也可由HCN 与NaOH反应制得。
已知:CH4(g)=C(s)+2H2(g) △H1;
2HCN(g)=2C(s)+H2(g)+N2(g) △H2;
N2(g)+3H2(g) 2NH3(g) △H3。
2NH3(g) △H3。
则反应:CH4(g)+NH3(g) HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。
HCN(g)+3H2(g)的△H=____________(用含△H1、△H2、△H3的代数式表示)。








