-
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4
C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
-
Ⅰ.已知NH3•H2O与醋酸的电离度在同温同浓度下相等。向少量Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,结果固体完全溶解。
甲同学的解释是:
Mg(OH)2 (固) Mg2++2OH- (1)
Mg2++2OH- (1)
NH4++H2O NH3H2O+H+ (2)
NH3H2O+H+ (2)
H++OH- H2O (3)
H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2 (固) Mg2++2OH- (1)
Mg2++2OH- (1)
NH4Cl=NH4++Cl- (2)
NH4++OH- NH3H2O (3)
NH3H2O (3)
由于(3)的发生,使平衡(1)右移,沉淀溶解。
丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。
(1)他选用的试剂是__________(填写编号)。
A. NH4NO3 B. CH3COONH4 C. Na2CO3 D. NH3•H2O
(2)实验步骤:____________________________;
(3)实验结论:____________________________。
Ⅱ.关于“电解氯化铜溶液时的pH变化”问题,化学界有两种不同的观点。
观点一:“理论派”认为电解氯化铜溶液后溶液的pH升高;
观点二:“实验派”经过反复、多次、精确的实验测定,证明电解氯化铜溶液时的pH的变化如图。请回答下列问题:
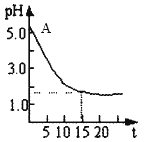
(1)用离子方程式表示电解前氯化铜溶液的pH处于A点的原因:______________。
(2)“理论派”所持观点的理论依据是:_______________________。
(3)你支持哪种观点:_________(理论派、实验派)。其理由是_____________。
-
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
-
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
-
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
-
下列叙述正确的是( )
A. 盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B. 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C. 饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D. 同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
-
下列有关电离和水解的说法正确的是( )
A. 醋酸溶液中加入冰醋酸,电离平衡正向移动,醋酸的电离程度增大
B. 升温,醋酸钠溶液的水解程度增大,c(OH-)增大,pH也增大
C. 等体积等浓度的醋酸和氨水混合后,溶液显中性,则水电离出的c(H+)为10-7 mol/L
D. 醋酸溶液中加水稀释,溶液中c(H+)/c(CH3COO-)增大,n(H+)减小。
-
(6分)(2012•重庆)下列叙述正确的是( )
A. 盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B. 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C. 饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
-
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,在等体积、等浓度的硝酸中加入 氨水,溶液的导电性增强
氨水,溶液的导电性增强
C.25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当
D.25℃时,将等体积pH=1的盐酸和水混合,混合后溶液的pH=1.3
-
下列叙述正确的是
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小6 e; U5 G" b0 F5 ]
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变5 I0 d7 L- b% ?5 \3 L/ I8 ]8 U
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
Mg2+(aq)+2OH-(aq)①
NH3·H2O+H+②
H2O③
Mg2+(aq)+2OH-(aq)①
NH3·H2O②
