-
海带中提取碘的一种流程如下:
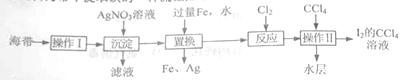
(1) “操作Ⅰ”的主要目的的是获得含I-的溶液,它包括灼烧、水浸。其中灼烧时装置如右图所示,仪器A的名称为__。
(2)“置换”所得滤渣中含有Fe和Ag。
①使用化学方法分离出Ag操作是__。
②分离出的Ag用稀硝酸转化为AgNO3,以循环利用,相关离子方程式为__。
(3)“操作Ⅱ”得到水层的方法是:将通入Cl2后的溶液置于分液漏斗中,加入CC14,振荡静置,__。
(4)检验“操作Ⅱ”所得水层中是否含有Fe3+的方法是__。
【答案】 坩埚 将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤 3Ag+4H++NO =3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+
【解析】流程分析:海带中提碘的操作为,先灼烧海带,再水浸溶解,过滤除去不溶性杂质,得到含I-的溶液。加入硝酸银溶液沉淀I-,得到AgI沉淀,此为富集碘的过程。再向AgI固体中加入过量的铁和水,不断的搅拌,反应生成Ag单质固体和FeI2溶液,过滤,滤液为FeI2溶液,滤渣为Ag和未反应完的Fe。向滤液FeI2中通入Cl2,生成I2和FeCl3(或FeCl2);加入CCl4萃取,分液分离得到I2的CCl4溶液。
(1)图中A为坩埚;
(2)①滤渣中含有Fe和Ag,可以利用Fe和Ag的活泼性不同,用酸将二者分离。Fe与稀硫酸、盐酸反应,而Ag不反应,故可以用稀硫酸或盐酸分离Fe和Ag。具体操作为:将固体混合物溶于足量的稀H2SO4(或稀盐酸),过滤;
②Ag可以和稀硝酸反应生成AgNO3、NO和水,离子方程式为3Ag+4H++NO3-=3Ag++NO↑+2H2O;
(3)操作II为加入CCl4萃取,有机层为I2的CCl4溶液。CCl4的密度大于水,先将下层的有机溶液放入烧杯中,再将上层液体从上口倒出。具体操作为:打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中;
(4)可以利用KSCN检验溶液中是否含有Fe3+,具体操作为为:取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+。
【题型】综合题
【结束】
25
利用钛白工业的副产品FeSO4[杂质仅为少量[Fe2(SO4)3]可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
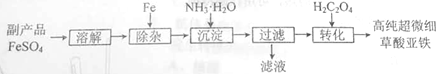
(1)用离子方程式表示“除杂”的原理:__。
(2) “沉淀”过程控制反应温度为40℃,温度不宜过高的原因是__。
(3)实验室测定副产品FeSO4杂质仅为少量[Fe2(SO4)3]+ Fe2(SO4)3含量的步骤如下:
步骤1:将适量副产品配成水溶液,向其中加入2mol•L-1BaCl2溶液使SO42-沉淀完全,过滤。
步骤2:将步骤1所得沉淀洗涤,烘干至恒重,称得其质量为11.65 g。
步骤3:用0.2000mol•L-1KMnO4溶液与步骤1所得滤液作用,恰好完全反应时消耗其体积为20.00 mL。
(该步骤中反应的方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe3++Mn2++4H2O)
①步骤1中证明SO42-沉淀完全的操作为__。
②欲配制0.2000 mol•L-1 KMnO4 50 mL,若定容时俯视,则所配KMnO4溶液浓度会__。(填“偏大”、“偏小”、“不变”)
③该副产品中所含杂质Fe2(SO4)3的物质的量为__。
-
某学习小组做了如下实验探究海带中碘元素的存在形式,探究过程如图:
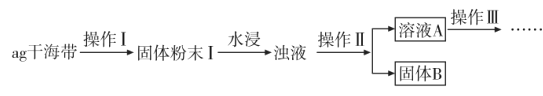
(1)操作I为灼烧,则灼烧时应该用___(仪器名称)盛装海带,操作II为___;
(2)水浸时通常要将悬浊液煮沸2-3min,目的是___。
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
推测:①以IO 形式存在②以I-形式存在
形式存在②以I-形式存在
查阅资料:IO 具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
具有较强的氧化性将上述溶液稀释配制成200mL溶液,请完成下列实验探究。
限选试剂:3%H2O2溶液、KSCN溶液、FeC12溶液、稀硫酸
| 序号 | 实验操作 | 实验现象 | 结论 |
| ① | 取少量稀释后的溶液A加入淀粉后再 用硫酸酸化,分装于试管I、II | 无现象 | |
| ② | 往试管I中加入FeC12溶液,然后加入2滴KSCN溶液并振荡; | ___ | 证明不是以IO 形式存在 形式存在 |
| ③ | 往试管II中加入___; | ____ | 证明以I-形式存在 |
(4)取20mL稀释后溶液A于锥形瓶,滴加0.01mo1/LKMnO4溶液至溶液刚显浅红色,将I-氧化为I2并得到溶液B;已知在酸性条件下,MnO 的还原产物为Mn2+,写出离子方程式___。
的还原产物为Mn2+,写出离子方程式___。
-
海带中提取碘单质,成熟的工艺流程如下

下列关于海水制碘的说法,正确的是
A. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B. 可用酒精萃取碘水中的I2
C. 沸水浸泡海带灰的目的是为了加快I-的溶解,并使之溶解更充分
D. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
-
从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程。下列有关图示操作正确的是( )

A. 用装置甲将海带灼烧成灰 B. 用装置乙过滤得含I-的溶液
C. 用装置丙分离出碘的CCl4溶液 D. 用装置丁蒸馏获得碘并回收CCl4
-
从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程。下列有关图示操作正确的是( )

A. 用装置甲将海带灼烧成灰 B. 用装置乙过滤得含I-的溶液
C. 用装置丙分离出碘的CCl4溶液 D. 用装置丁蒸馏获得碘并回收CCl4
-
实验室里化学兴趣小组探究活动是:从海带中提取碘,他们先将海带灼烧成灰,加入热水并搅拌成浊液,接下来的流程如下:(每一步反应均充分)
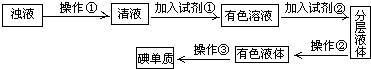
(1)指出过程中有关的实验操作①和②名称:①______,②______.
(2)选择试剂①时,若要考虑实验尽量不放出有害气体,可选择______
A.氯气 B.氟化钠 C.稀硫酸 D.次氯酸钠
实验指导教师则给出了10%H2O2和2mol/L稀硫酸,请写出碘离子与这些物质发生反应的离子方程式:______
(3)选择试剂②,可供选择的试剂是______.
A.酒精 B.CCl4C.苯 D.氢氧化钠
(4)在操作②过程中:①分液漏斗中上层液体从______.
②要检验在操作②后水溶液中是否含碘单质的方法:______.
(5)有色液体呈______色.从此液体中提取碘和回收有机溶剂,还需要经过蒸馏过程.指出下图蒸馏实验装置中的错误是______
①温度计水银球位置错误 ②冷却水的方向错 ③酒精灯加热错 ④烧杯直接加热错.

-
从海带中提取碘应该包括灼烧、溶解、过滤、氧化、萃取、蒸馏等过程。下列有关图示操作正确的是( )

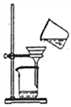
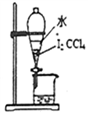
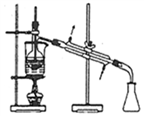
甲 乙 丙 丁
A. 用装置甲将海带灼烧成灰 B. 用装置乙过滤得含I-的溶液
C. 用装置丙分离出碘的CCl4溶液 D. 用装置丁蒸馏获得碘并回收CCl4
-
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在.实验室里从海洋植物海带中提取碘的流程如下:

(1)灼烧海带时,盛放海带的仪器是 。
(2)用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验可分解为如下各步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50 mL碘水和15 mL四氯化碳加入分液漏斗中,并盖好玻璃塞
C.检查分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收下层溶液
F.从分液漏斗上口倒出上层溶液
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准分液漏斗上的小孔
H.静置、分层
正确的操作顺序是 。
静置分层后,下层溶液的颜色为 。
(3)从碘的CCl4溶液中获得碘晶体还需要经过蒸馏,该实验需要的玻璃仪器除酒精灯、蒸馏烧瓶、温度计、锥形瓶、牛角管外,还需要 ,实验中温度计水银球所处位置为 。
-
实验室中,从海带里提取碘的部分流程如下图,下列说法不正确的是

A. 步骤①灼烧海带需要用坩埚
B. 步骤③主要操作为过滤
C. 步骤④主要反应为:2I-+H2O2+2H+=2H2O+I2
D. 步骤⑤可以加入酒精萃取I2
-
从海带中提取碘单质的工艺流程如下。下列关于海水制碘的说法,不正确的是( )
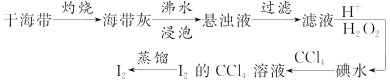
A. 在碘水中加入几滴淀粉溶液,溶液变蓝色
B. 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
C. 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
D. 碘水加入CCl4得到I2的CCl4溶液,该操作为“萃取”


=3Ag++NO↑+2H2O 打开旋塞,将下层液体放入烧杯中,关闭旋塞,将上层液体倒入另一烧杯中 取少量“操作Ⅱ”所得水层,加入KSCN溶液,若变红,则含有Fe3+,若不变红,则不含有Fe3+













