-
氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____________。
(2)在一密闭容器中投入一定量的氨气,发生反应2NH3 N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。

请回答:
①曲线A中,反应在前2min内氢气的平均反应速率为________。此条件下的平衡常数K=____。
②在其它条件相同时,若改变某一条件,使该反应发生如图曲线B的反应情况,则此条件可能是改变_________(填“浓度”、“压强”、“温度”或“催化剂”)。简述判断理由_________。
(3)一定温度下,在恒压密闭容器中N2O5可发生下列反应:
①2N2O5(g) 4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6mol/L,c(O2)=1.2mol/L,则反应②中NO2的转化率为______,N2O5(g)的起始浓度应至少大于______mol/L.
-
氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
| 离子 | NO3- | NO2- | Cl- |
| c/(mol • L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
-
二氧化硫和氮的氧化物是大气的主要污染物,关注臭氧层、防止和治理环境污染是当前环保工作的重要研究内容之一.
(1)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应.下列有关说法正确的是______.
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)一定条件下,2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=______;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率______50%(选填“>”、“<”或“=”).
(3)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气,臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如图:
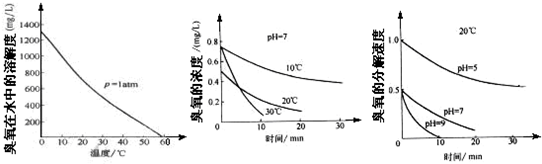
用臭氧消毒自来水,适宜的条件是______.
(4)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
若2mol ZnFe2Ox与SO2可生成0.75mol S,x=______.

-
(本题共16分)防治环境污染是当前环保工作的重要研究内容之一。二氧化硫和氮氧化物是大气的主要污染物。
1.将1.5 mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到_________________g石膏(CaSO4•2H2O)。
2.用CH4消除NOx污染的化学方程式为:
CH4+4NO → 2N2+CO2+2H2O; CH4+2NO2 → N2+CO2+2H2O
现有11.2 L NO2、NO的混合气体NOx,将其还原为N2,需要4.48 L 的CH4,则混合气体中NO2、NO的物质的量分别为___________________。(体积都已换算为标准状况)
3.(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2可生成0.5 mol N2,则y=_______________。
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3。已知1 mol ZnFe2Oz最多能使4.0 L(标况)NO1.4转化为N2。则上述氧化物形式的化学式可具体表示为______________________________。
4.低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐。其主要反应如下:
NO+O3 → NO2+O2 ……………………………………………①
2NO2+O3 → N2O5+O2 …………………………………………②
N2O5+2NH3+H2O → 2NH4NO3 ………………………………③
SO2+O3+2NH3+H2O → (NH4)2SO4+O2 ……………………④
某热电厂烟气中平均含NOx 4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90 L/m3,臭氧空气与加湿氨气和烟气混合反应。若 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。
-
防治环境污染是当前环保工作的重要研究内容之一.二氧化硫和氮氧化物是大气的主要污染物.
(1)将1.5mol SO2用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到______g石膏.
(2)用CH4消除NOx污染的化学方程式为:
CH4+4NO→2N2+CO2+2H2O; CH4+2NO2→N2+CO2+2H2O
现有11.2L NO2、NO的混合气体NOx,将其还原为N2,需要4.48L 的CH4,则混合气体中NO2、NO的物质的量分别为______.(体积都已换算为标准状况)
(3)(1)常温下用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4.若2mol ZnFe2Oy与足量NO2可生成0.5mol N2,则y=______.
(2)氧缺位铁酸锌ZnFe2Oz化学式的氧化物形式为aZnO•bFeO•cFe2O3.已知1mol ZnFe2Oz最多能使4.0L(标况)NO1.4转化为N2.则上述氧化物形式的化学式可具体表示为______.
(4)低温臭氧氧化脱硫脱硝技术可以同时吸收烟气中的氮氧化物和二氧化硫,反应原理是将NOx氧化成N2O5,通过洗涤形成硝酸盐,二氧化硫形成硫酸盐.其主要反应如下:
NO+O3→NO2+O2 …①
2NO2+O3→N2O5+O2…②
N2O5+2NH3+H2O→2NH4NO3 …③
SO2+O3+2NH3+H2O→(NH4)2SO4+O2…④
某热电厂烟气中平均含NOx4.5‰、SO2 9.0‰(体积分数),压缩空气经臭氧发生器变成臭氧空气,其中O3浓度为90L/m3,臭氧空气与加湿氨气和烟气混合反应.若 流量比为y,请通过计算列出y与x的关系式.
流量比为y,请通过计算列出y与x的关系式.
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g)+O2(g) -2NO2(g)△H的反应历程分两步:
-2NO2(g)△H的反应历程分两步:
①2NO(g) N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2(g)+ O2(g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g)+O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
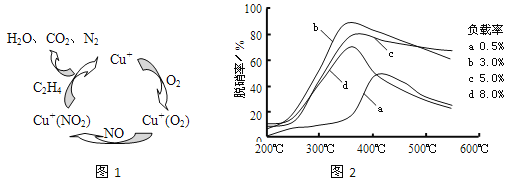
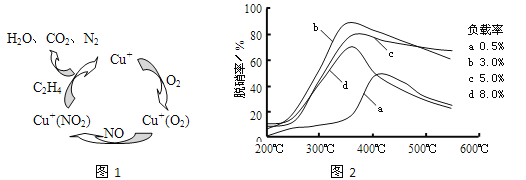
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO):n(O2) =2:1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
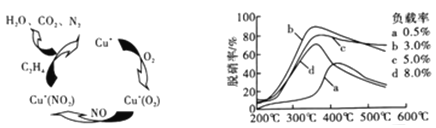
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→+O2-+1/2O2+V。______________
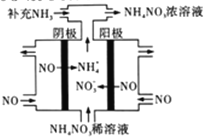
(3)电解NO可制备NH4NO3,其工作原理如右图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
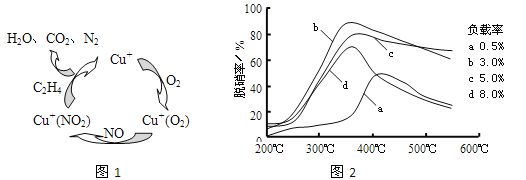
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
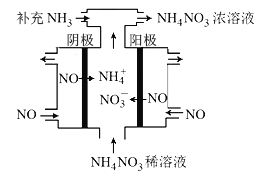
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
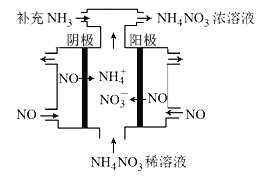
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。回答下列问题:
(1)已知2NO(g) +O2(g) -2NO2(g) △H的反应历程分两步:
-2NO2(g) △H的反应历程分两步:
①2NO( g ) N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
N2O2 (g)( 快 ) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c2(N2O2)
②N2O2 (g)+ O2 (g)  2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0,v2正=k2正c2(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小: E1__ E2 (填“>”、“<”或“=”) 其判断理由是__________;2NO(g) +O2(g) 2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)
2NO2(g) 的平衡常数K与上述反应速率常数k1正、k1逆、k2正、 k2逆的关系式为_______;已知反应速率常数k随温度升高而增大,若升高温度后k2正、 k2逆分别增大a倍和b倍,则a____b (填“>”、“<”或“=”);一定条件下,2NO (g)+O2(g)  2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
2NO2 (g)达平衡后,升高到某温度,再达平衡后v2正较原平衡减小,根据上述速率方程分析,合理的解释是_________________。
(2)①以乙烯(C2H4)作为还原剂脱硝(NO),其脱硝机理如左下图所示,若反应中n(NO): n(O2) =2 :1,则总反应的化学方程式为_______________;脱硝率与温度、负载率(分子筛中催化剂的质量分数) 的关系如右下图,为达到最佳脱硝效果,应采用的条件是________________。
②用NO可直接催化NO分解生成N2、O2,将其反应机理补充完整(Vo代表氧空穴):
2Ni2++2Vo+2NO→2Ni3++2O-+N2 2O-→O2-+1/2O2+Vo ______________
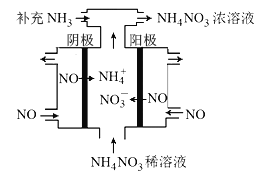
(3)电解NO可制备NH4NO3,其工作原理如图所示,阴极的电极反应式为______________。
-
氮和硫的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)2NO(g)+O2(g) 2NO2(g)的基元反应如下(E为活化能):
2NO2(g)的基元反应如下(E为活化能):
2NO(g) N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g) E1=82kJ·mol-1 v=k1c2(NO)
N2O2(g) 2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
2NO(g) E-1=205kJ·mol-1 v=k-1c(N2O2)
N2O2(g)+O2(g) 2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g) E2=82kJ·mol-1 v=k2 c(N2O2)·c(O2)
2NO2(g) N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
N2O2(g) + O2(g) E-2=72kJ·mol-1 v=k-2 c2(NO2)
①2NO(g)+O2(g) 2NO2(g) ∆H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
2NO2(g) ∆H=__kJ·mol-1,平衡常数K与上述反应速率常数k1、k-1、k2、k-2的关系式为K=__;
②某温度下反应2NO(g) +O2(g) 2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
2NO2(g)的速率常数k=8.8×10-2L2·mol-2·s-1,当反应物浓度都是0.05mol·L-1时,反应的速率是__mol·L-1·s-1;若此时缩小容器的体积,使气体压强增大为原来的2倍,则反应速率增大为之前的__倍。
(2)2SO2(g)+O2(g) 2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
2SO3(g)反应过程中能量变化如图1所示。在V2O5存在时,该反应的机理为:V2O5+SO2→2VO2+SO3(快) 4VO2+O2→2V2O5(慢)
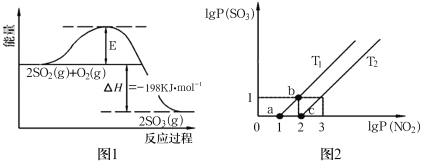
下列说法正确的是__(填序号)。
a.反应速率主要取决于V2O5的质量
b.VO2是该反应的催化剂
c.逆反应的活化能大于198kJ·mol-1
d.增大SO2的浓度可显著提高反应速率
(3)某研究小组研究T1℃、T2℃时,氮硫的氧化物的转化:NO2(g)+SO2(g) NO(g)+SO3(g) ∆H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g) ∆H<0中1gP(NO2)和lgP(SO3)关系如图2所示,实验初始时体系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①T1__T2(填“>”“<”或者“=”),温度为T1时化学平衡常数Kp=__。
②由平衡状态a到b,改变的条件是__。
N2+3H2△H>0,反应过程中NH3的浓度随时间变化的情况如图所示。

4NO2(g)+O2(g) ②2NO2(g)
2NO(g)+O2(g)










