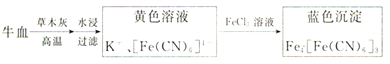-
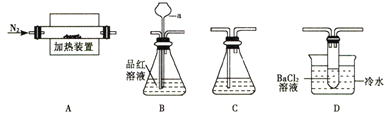
硫酸亚铁晶体(FeSO4·xH2O)是制备多种药物的重要原料,受热易分解。(1)甲组同学设计 如下图所示装置,探究硫酸亚铁晶体受热分解产物和结晶水含量。已知:SO3的熔点为16.8℃,沸点是44.8℃;能被浓硫酸充分吸收;溶于水放出大量热,易形成酸雾。
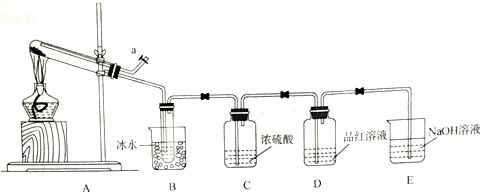
①装置B的作用 。
②点燃酒精灯之前,需在a处向装置中通入一段时间的N2,目的为 。
③实验过程中,观察到装置C中产生少许酸雾,装置D中品红溶液褪色,则分解产物中一定有 (填化学式)
④若实验开始前,向试管中加入27.8g硫酸亚铁晶体,充分分解后,停止加热至试管冷却,测得B、C共增重16.6g。试管冷却过程中,同时需要进行的操作为 。
⑤进一步检验装置A中残留固体成分:取少量固体,溶于适量稀硫酸,滴加酸性KMnO4溶液,无明显现象,则生成固体的俗名为 。
⑥通过上述实验,可得出n(FeSO4·xH2O)= (列出表达式并计算);该晶体分解的化学方程式为
(2)乙组同学为证明酸性:H2SO3>H2CO3>H2SiO3,选用甲组实验中的装置A、B、C和下图所示的部分装置进行实验。
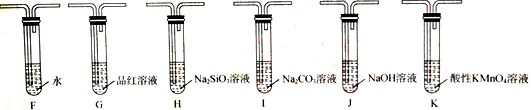
①乙组同学的实验装置中,依次连接的合理顺序为A、B、C、 (填装置字母)
②能证明H2CO3的酸性强于H2SiO3的现象为: 。
-
硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置探究FeSO4受热分解的产物。
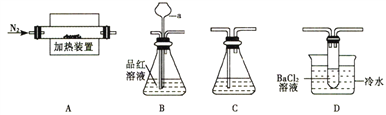
(1)甲组同学利用“A 接B 接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________。
②仪器a 的名称是_______________;其作用是____________________。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2 外还有SO3;SO3 的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3 。
①装置D中的现象是_________________,BaCl2 溶液不能用Ba (NO3)2溶液代替的原因是______________________。
②装置A 中固体变为红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g( 假设杂质不反应),该硫酸亚铁样品的纯度为__________% (保留小数点后两位,下同),样品中铁元素的质量分数为_____________%。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:

(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________。
-
硫酸亚铁在工农业生产中具有广泛的应用。该物质不稳定,受热易分解产生氧化物,具有较强的还原性。
Ⅰ.某学习小组利用如下装置米探究FeSO4受热分解的产物。
(1)甲组同学利用“A 接B 接C”的装置来验证产物中含有SO2气体。
①连接好装置后,接下来的操作是____________________。
②仪器a 的名称是_______________;其作用是____________________。
(2)乙组同学查阅资料得:硫酸亚铁分解的气体产物中除SO2 外还有SO3;SO3 的熔点为16.8℃,沸点是46.8℃,溶于水放出大量的然,易形成酸雾。为此设计了“A接D接C”的装置验证产物中含有SO3 。
①装置D中的现象是_________________,BaCl2 溶液不能用Ba (NO3)2溶液代替的原因是______________________。
②装置A 中固体变为经红棕色,结合两组同学的实验,写出硫酸亚铁分解的化学方程式______________________。
③取硫酸亚铁样品18.20g,加热分解至恒重时测得固体质量为11.00g( 假设杂质不反应),该硫酸亚铁样品的纯度为__________% (保留小数点后两位,下同),样品中铁元素的质量分数为_____________。
Ⅱ.用硫酸亚铁碱性试纸可检验食品中是否含有CN-,方案如下:

已知:蓝色染料普鲁士蓝的合成方法如下:
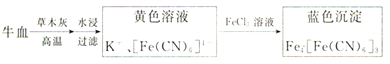
(3)若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因______________________。
-
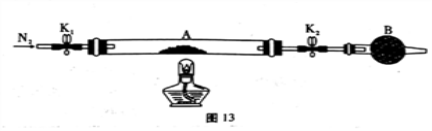
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
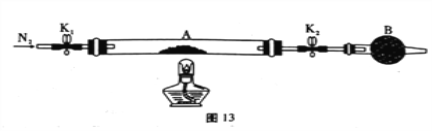
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
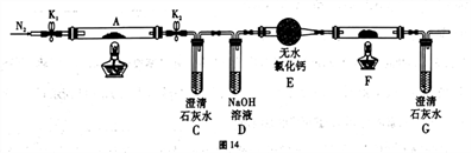
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
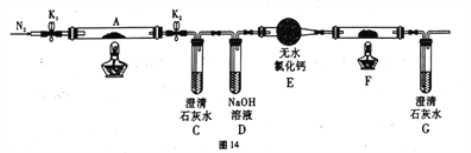
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
草酸亚铁晶体是一种淡黄色粉末,常用于照相显影剂及制药工业,也是电池材料的制备原料。某化学兴趣小组对草酸亚铁晶体的一些性质进行探究。
(1)甲组同学用图13所示装置测定草酸亚铁晶体(FeC2O4·xH2O)中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为ag。将样品装入石英玻璃管中,再次将装置称重,记为b g。按图连接好装置进行实验。
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯加热;
c.熄灭酒精灯;
d.冷却至室温;
e.关闭K1和K2;
f.称重A;
g.重复上述操作,直至A恒重,记为cg。
①仪器B的名称是____________________。
②根据实验记录,计算草酸亚铁晶体化学式中的x =____________(列式表示);若实验时a、b次序对调,会使x值______________ (填“偏大” “无影响”或“偏小”)。
(2)乙组同学为探究草酸亚铁的分解产物,将(1)中已恒重的装置A接入图14所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后装置A中残留固体为黑色粉末。
①装置C、G中的澄清石灰水均变浑浊,说明分解产物中有_______________(填化学式)。
②装置F中盛放的物质是:______________________ (填化学式)。
③将装置A中的残留固体溶于稀盐酸,无气泡,滴入KSCN溶液无血红色,说明分解产物中有:_________________ (填化学式)。
④写出草酸亚铁(FeC2O4)分解的化学方程式:______________________。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
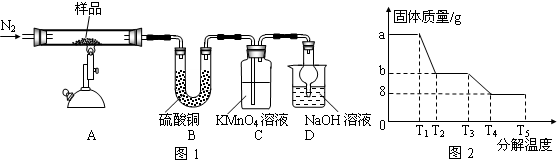
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有________。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式________。
(5)装置D球形干燥管的作用________。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x=。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
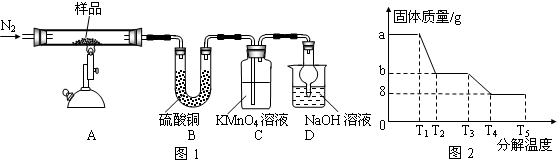
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有。
(2)实验中要持续通入氮气,否则测出的x会(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式。
(5)装置D球形干燥管的作用。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x
=_________________________。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
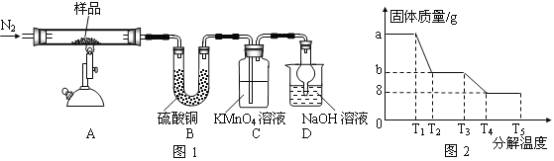
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
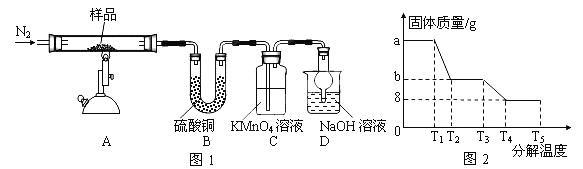
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 _____。
(2)实验中要持续通入氮气,否则测出的x会 ___(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3 。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3 ,写出FeSO4 分解的化学方程式 __。
(5)装置D球形干燥管的作用 ____。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4·xH2O中的x= _____。
-
研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
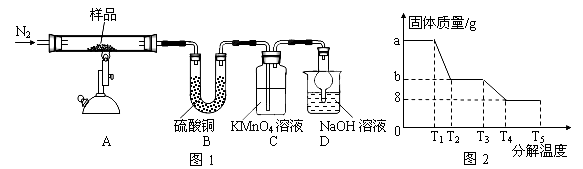
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x= 。