-
(10分)工业上合成氨的反应:N2(g)+3H2(g) 2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g)ΔH=-92.60 kJ·mol-1。
(1)在绝热、容积固定的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成6n mol N—H键的同时生成2n mol H—H键
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
④混合气体的平均摩尔质量增大
⑤容器内的气体密度不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
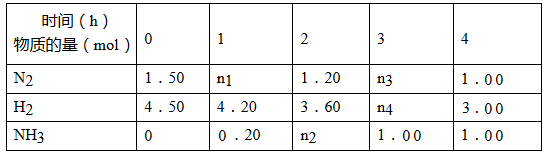
根据表中数据计算:
①反应进行到2 h时放出的热量为_________________kJ。
②此温度下该反应的化学平衡常数K=_________________(保留两位小数)。
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________________方向移动(填“正反应”或“逆反应”或“不移动”)。
④有甲、乙两个完全相同的容器,向甲容器中加入1 mol N2 (g)和6mol H2 (g),在一定条件下达到平衡时的热效应(吸热或放热)为Q,在相同条件下向乙容器中加入2 mol NH3 (g)和3mol H2 (g),达到平衡时的热效应(放热或吸热)为4Q。则甲容器中H2的转化率为________________。
-
合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g) N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
-
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2 (g) + 3H2 (g)  2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
2NH3 (g) △H = -92.4 kJ·mol-1 , 一种工业合成氨的简易流程图如下:
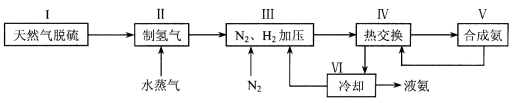
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(2)步骤Ⅱ中制氢气原理如下:
① CH4 (g) + H2O (g)  CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
CO (g) + 3H2 (g) △H = +206.4 kJ·mol-1
② CO (g) + H2O (g)  CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
CO2 (g) + H2 (g) △H = -41.2 kJ·mol-1
写出氢气和二氧化碳气体反应生成甲烷和水蒸气的热化学方程式 。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
a.升高温度 b.增大水蒸气浓度
c.加入催化剂 d.降低压强
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) 。
(4)用氨气制取尿素[CO(NH2)2]的反应为:
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) ΔH<0
CO(NH2)2(l)+H2O(g) ΔH<0
某温度下,向容积为100L的密闭容器中通入4mol NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。若保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应(0~70s)的进程曲线。

(5)25℃时,向a mol NH4NO3固体中滴加b L氨水后溶液恰好呈中性,所滴加氨水的浓度为 mol·L-1(25℃时,NH3·H2O的电离平衡常数Kb=2×10-5)
-
合成氯是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)⇋N2(g) + 3H2(g) 的平衡常数K=___(mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
-
Ⅰ.氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
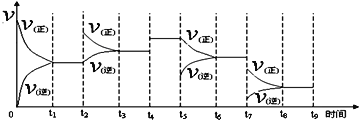
t5 ___________________。t7___________________。
Ⅱ.已知化学反应①:Fe(s)+CO2(g)  FeO(s)+CO(g), 其平衡常数为K1;
FeO(s)+CO(g), 其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2。
FeO(s)+H2(g),其平衡常数为K2。
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)1173K时,若c(CO2)=2mol/L,c(CO) =5mol/L,则此时反应①平衡向__________(填“正”或“逆”)反应方向移动。
(2)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
能判断反应③已达平衡状态的是_______________________________。
A.恒容容器中压强不变 B.混合气体中c(CO)不变
C. (H2)==
(H2)== (H2O) D.c(CO2)==c(CO)
(H2O) D.c(CO2)==c(CO)
(3)723K时,0.2molCO2和0.1molH2通入抽空的1L恒容密闭容器中,发生反应③,达到平衡后水的物质的量分数为0.1。则H2的转化率α(H2)=___________%。723K该反应的平衡常数为K=________________。(结果保留两位有效数字)
-
(9分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t2________t4 ________t5 ________ t7________。
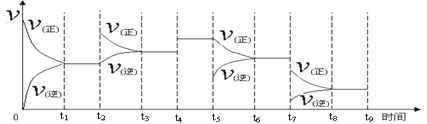
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
工业合成氨反应为3H2(g) + N2(g) ⇋ 2NH3(g) ΔH<0,下列措施能使反应物中活化分子百分数增大的方法是
①增大N2的浓度;②升高温度;③增大压强;④移去NH3;⑤加入催化剂;
A.①②③ B.①②③⑤ C.①②③④⑤ D.②⑤
-
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
-
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A.一定大于92.0 kJ B.一定等于92.0 kJ
C.一定小于92.0 kJ D.不能确定
-
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g ) 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为( )
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定
2NH3(g)ΔH=-92.60 kJ·mol-1。
2NH3(g),下列说法能说明上述反应向正反应方向进行的是____________________(填序号)。




