-
钴基合金中含少量镁、镍和铁元素,在化工、航空航天和机械工业应用广泛。现有钴基废合金需要回收再利用,设计流程如图:
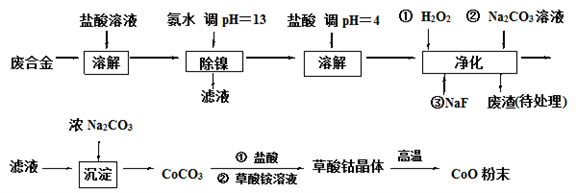
已知:1)有关钴、镍、镁、铁化合物的性质见下表:
| 化学式 | 沉淀开始时的pH | 沉淀完全时的pH | 有关性质 |
| Co(OH)2 | 7.2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3·H2O=Co(OH)2↓+2NH4+ Co2++2H2O Co(OH)2+2H+ Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 7.1 | 9.6 |
| Fe(OH)3 | 2.3 | 3.7 |
| Mg(OH)2 | 10.8 | 12.4 |
2)25℃ Ksp(MgF2)=7.4×10—11、Ksp(MgCO3)=3.5×10—3
请回答:
(1)“除镍”步骤必须控制在一定时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3,此反应的化学方程式为________________。
(2)在“盐酸调pH=4”步骤中,加入盐酸的作用是______________________。
(3)“净化”步骤中加入H2O2的作用是_____________________(请用离子方程式表示)。废渣的成分___________________(请用化学式表示)。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数K=_________________________。
Fe(OH)3+3H+的平衡常数K=_________________________。
(5)二水合草酸钴晶体(CoC2O4·2H2O)中C元素的化合价为________,在空气中高温反应的化学方程式为_______________________。
-
银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
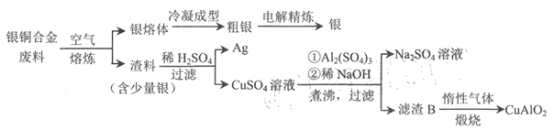
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
A.电解精炼时,粗银做阳极,纯银做阴极
B.为提高原料利用率,流程中应加过量的稀NaOH
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2
-
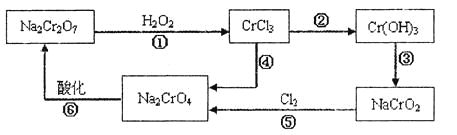
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:

已知:
(1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
-
铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量 FeS和 SiO2)中回收铍和铜两种金属的工艺流程如图:
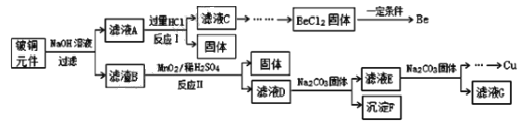
已知:
Ⅰ.铍、铝元素化学性质相似;
Ⅱ.常温下部分难溶物的溶度积常数如表:
| 难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的成分除 NaOH、Na2BeO2外,还有________(填化学式),写出反应I中Na2BeO2,与过量盐酸反应的化学方程式:_________________。
(2)从滤液C 中提纯纯BeCl2,最合理的实验步骤顺序为_________(填字母)
a.加入过量的氨水 b.通入过量 CO2 c.加入过量NaOH溶液 d.加入适量HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的离子方程式:__________。若用浓HNO3溶解金属硫化物,缺点是________(任写一条)
(4)滤液D中c(Cu2+)= 2.2 mol∙L-1、c(Fe3+) = 8.0×10 -3mol∙L-1、c(Mn2+)= 0.01mol∙L-1,逐滴加入 Na2CO3溶液调节pH 可将其转变成氢氧化物依次分离,首先沉淀的是______ (填离子符号)。为使铜离子开始沉淀,常温下应调节溶液的pH____4。
-
铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
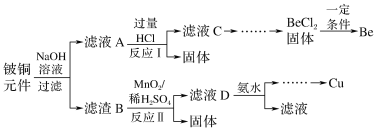
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
| 难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
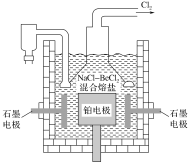
①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
| 物质 | 熔点(K) | 沸点(K) |
| Be | 1551 | 3243 |
| Na | 370 | 1156 |
-
镁在航空航天、国防工业等领域有广泛应用。某小组利用某工厂废弃物(主要含MgCO3、MgSiO3、Al2O3和Fe2O3)设计回收镁的工艺流程如下:
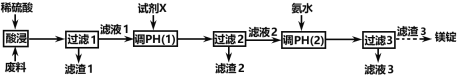
(1)酸浸过程中采用“粉碎废料、加热和搅拌、适当提高稀硫酸的浓度”等措施的目的是_________________________。
为了提高产品纯度,试剂X宜选择(________________)(填代号)。
A.CuO B.MgO C.MgCO3 D.氨水
(2)滤渣1的主要成分是____________:滤渣2的主要成分是____________(填化学式)。
(3)写出生成滤渣3的离子方程式_____________________。
(4)已知:298K,时,Ksp[Al(OH)3]=3.0 × 10-34, Ksp[Fe(OH)3]=4.0 × 10-38,加入试剂X,当Al3+开始沉淀时,溶液中c(Al3+)∕c(Fe3+)=________________。
(5)若废料中镁元素的质量分数为a% ,利用mkg这种废料按上述流程生产,最终回收到质量分数为b%的镁锭wkg,则它的产率为________% 。
(6)参照海水提镁的某些步骤和上述流程图,设计经三步由滤渣3得到镁锭的路线____________。
-
铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
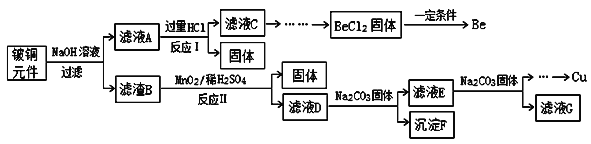
已知:I、铍、铝元素化学性质相似;
Ⅱ、常温下部分难溶物的溶度积常数如表:
| 难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH、Na2BeO2外,还有___________(填化学式),写出反应I中Na2BeO2与过量盐酸反应的离子方程式:________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:___________。若用浓HNO 3溶解金属硫化物,缺点是_______(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=8.0×10-3mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入Na2CO3溶液调节pH可将其转变成氢氧化物依次分离,首先沉淀的是_______(填离子符号);为使铜离子开始沉淀,常温下应调节溶液的pH大于______。
-
硼是动植物所必须的微量元素,其单质和化合物广泛应用于冶金、机械、化工、核工业、医药、农业等部门。利用硼镁矿(主要成分为Mg2B2O3·5 H2O) 制取制硼酸、金属镁及粗硼的工艺流程图如下:
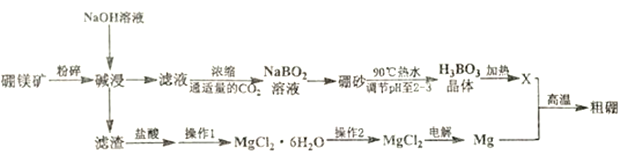
已知:①硼砂为Na2B4O7·10H2O
②硼酸(H3BO3) 是一种可溶于水的一元弱酸,与过量的NaOH 反应生成Na[B(OH)4]
③硼酸在不同温度下的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
| 溶解度(g/100g 水) | 3 | 3 | 5 | 7 | 9 | 11 | 15 | 18 | 23 | 29 |
(1) 粉碎硼铁矿的目的是:______________; Mg2B2O5·H2O 中B 的化合价为: ______价。
(2) 滤渣的主要成分是: ________
(3)硼酸的电子式: ________;写出硼酸在水中电离的方程式: ________________;
(4)X 为硼酸晶体加热完全脱水后的产物,其与Mg反应制取粗硼的化学方程式为: ________;
(5) 硼砂溶于90℃ 热水后,常用稀硫酸调pH 至2~ 3(酸性)制取HBO3晶体,该反应的离子方程式为: ________________;从上述溶液中获得H3BO3 晶体的操作: ________________。
-
中航工业成都飞机工业(集团)有限责任公司为中国航空事业做出了巨大贡献,先后研制了歼5、歼教5、歼7、歼教7、歼10、枭龙等歼击机和教练机。银铜合金广泛应用于航空工业。从切割废料中回收银并制备铜的化工产品工艺如下:

(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极电极反应式为 ;
滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,将红棕色气体溶于水的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)配平煅烧过程中一个反应的化学方程式:
CuO + Al2O3  CuAlO2 + ↑
CuAlO2 + ↑
(4)CuSO4溶液也可用于制备胆矾,其基本操作是 、 、过滤、洗涤和干燥。
(5)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为CuAlO2,至少需要1.0mol/L的Al2(SO4)3溶液 L。
-
铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO 25%、CuS71%、少量FeS 和SiO2)中回收铍和铜两种金属的流程。
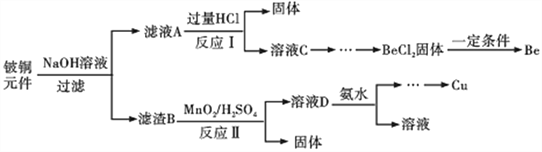
已知:Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38
Ksp[Mn(OH)2]=2.l×10-13
(1)原子序数为29 的Cu 的原子结构示意图为______________________。
(2)滤渣B的主要成分为___________________( 填化学式)。写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式___________________________________________。
(3)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序。
a.加入过量的NaOH b.过滤 c.加入适量的HCl
d.加入过量的氨水 e.通入过量的CO2 f.洗涤
②从BeCl2溶液中得到BeCl2 固体的操作是___________________________________。
(4)①MnO2 能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS 发生反应的离子方程式________________________________。
②若用浓HNO3溶解金属硫化物,缺点是_______________________(任写一条)。
(5)溶液D 中含c(Cu2+)=2.2 mol·L-1、c( Fe3+)=0.008 mol·L-1、c( Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH 可依次分离,首先沉淀的是___________(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH 大于________。
(6)取铍铜元件1000g,最终获得Be 的质量为72 g,则Be 的产率是________。

Fe(OH)3+3H+的平衡常数K=_________________________。










