-
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应3C12+6NaOH 5NaC1+NaC1O3+3H2O
5NaC1+NaC1O3+3H2O
先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
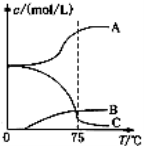
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是 。
-
氯酸钠(NaClO3)是无机盐工业的重要产品之一。
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
5NaC1+NaC1O3+3H2O,先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图所示,图中C表示的离子是 。
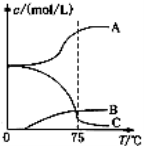
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则反应化学方程式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L(NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,消耗体积15.62mL。
步骤4: 。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③为精确测定样品中C1O3-的质量分数,步骤4操作为 。
(5)在上述操作无误的情况下,所测定的结果偏高,其可能的原因的原因是
-
(1)工业上制取氯酸钠采用在热的石灰乳中通入氯气,然后结晶除去氯化钙后,再加入适量的 (填试剂化学式),过滤后即可得到。
(2)实验室制取氯酸钠可通过如下反应:3C12+6NaOH 5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是 。(填离子符号)
5NaC1+NaC1O3+3H2O先往-5℃的NaOH溶液中通入适量C12,然后将溶液加热,溶液中主要阴离子浓度随温度的变化如右图表1所示,图中C表示的离子是 。(填离子符号)
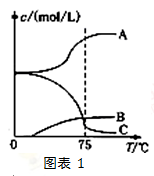
(3)某企业采用无隔膜电解饱和食盐水法生产氯酸钠。则阳极反应式为: 。
(4)样品中C1O3-的含量可用滴定法进行测定,步骤如下:
步骤1:准确称取样品ag(约2.20g),经溶解、定容等步骤准确配制1000mL溶液。
步骤2:从上述容量瓶中取出10.00mL溶液于锥形瓶中,准确加入25mL 1.000mol/L (NH4)2Fe(SO4)2溶液(过量),再加入75mL硫酸和磷酸配成的混酸,静置10min。
步骤3:再在锥形瓶中加入100mL蒸馏水及某种指示剂,用0.0200mol/L K2Cr2O7标准溶液滴定至终点,记录消耗消耗K2Cr2O7标准溶液的体积。
步骤4:为精确测定样品中C1O3-的质量分数,重复上述步骤2、3操作2-3次。
步骤5:数据处理与计算。
①步骤2中反应的离子方程式为 ;
静置10min的目的是 。
②步骤3中K2Cr2O7标准溶液应盛放在 (填仪器名称)中。
③用0.0200mol/L K2Cr2O7标准溶液滴定的目的是 。
④在上述操作无误的情况下,所测定的结果偏高,其可能的原因是 。
-
下列符合实际并用于工业生产的是
A.工业炼铝:电解熔融的氯化铝
B.制取漂粉精:将氯气通入澄清石灰水
C.工业制纯碱:在饱和氯化钠溶液中通入二氧化碳气体,煅烧反应所得沉淀
D.工业制硫酸:用硫磺为原料,经燃烧、催化氧化、最后用98.3%浓硫酸吸收
-
下列说法不正确的是( )
A.电解熔融氯化钠可得到氯气
B.工业上以氯气和石灰水为原料制取漂白粉
C.高炉炼铁的主要原料为铁矿石、焦炭、空气、石灰石
D.我国古代采用加热绿矾(FeSO4•7H2O)的方法制取硫酸
-
铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
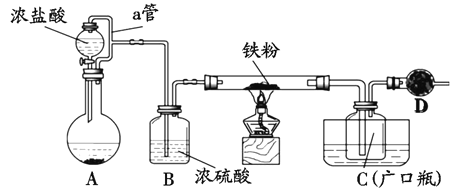
氯化亚铁:熔点670℃, 易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。
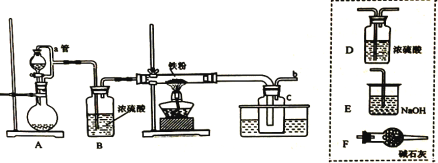
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是_____________________________________。
(3)导管b 口应与_______________ (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为______%。
(5)由上分析数据和计算得出结论:
①用此装置制得的无水氯化铁含铁_________偏高,偏低),显然其中含有较多________的杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是___________________。
-
铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化业铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通人氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装詈(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为____。
(2)仪器D的名称是____;D中装的约品是碱石灰,其作用是____。
(3)定性分析。取C中的少量产物溶于稀盐酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的____(只能选取一种试剂,填序号)进行检测,实验现象是____。
①H2O2溶液 ②K3[Fe(CN)6]溶液 ③KSCN溶液
④酸性KMnO4溶液 ⑤KI一淀粉溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中铁元素的质量分数为____%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施:
①用题目所给的装置制得的产物中,铁元素含量____(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是____。
-
铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________%。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________。
-
铁有两种氯化物,都是重要的化工试剂,它们的一些性质及制备方法如下所示:
Ⅰ.氯化铁:熔点为306 ℃,沸点为315 ℃,易吸收空气中的水分而潮解。工业上采用向500~600 ℃的铁粉中通入氯气来生产无水氯化铁。
Ⅱ.氯化亚铁:熔点为670 ℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题:
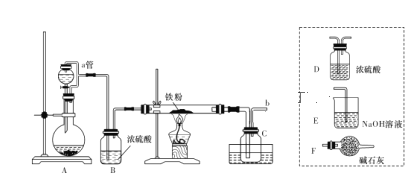
(1)装置A用于KMnO4固体与浓盐酸反应制氯气,a管的作用是______________,反应的离子方程式为__________。
(2)导管b口应与_______________(从虚线框内装置中选择一个装置,用字母代号填空)连接,这样可避免反应系统与环境间的相互影响。
(3)实验完成后,取广口瓶C中收集到的产物进行如下测定
①称取4.2 g样品溶于过量的稀盐酸中;②加入足量H2O2;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40 g。则该样品中铁元素的质量分数为_________。
(4)由以上数据分析和计算得出结论:
①用此装置制得的无水氯化铁含铁量___________ (填“偏高”或“偏低”),显然其中含有较多的___________(填化学式)杂质。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是 ______。
-
下列实验目的可以达到的是
A.电解熔融氯化镁制取金属镁
B.醋酸钠结晶水合物与碱石灰共热制取甲烷
C.浓硫酸与溴化钠共热制取溴化氢
D.饱和碳酸钠溶液除去二氧化碳中的氯化氢
5NaC1+NaC1O3+3H2O






