-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
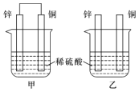
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
甲 乙 丙
①下列说法正确的是________。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲________乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:________________________________。
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为________。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为____________________________________________________________。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

甲 乙 丙
①下列说法正确的是________。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲________乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:________________________________。
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为________。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为____________________________________________________________。
-
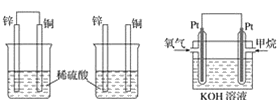
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
甲 乙 丙
①下列说法正确的是________。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度:甲________乙(填“>”“<”或“=”)。
③请写出图中构成原电池的负极电极反应式:________________________________。
④当甲中溶液质量增重31.5 g时,电极上转移电子数目为________。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。通甲烷一极的电极反应方程式为____________________________________________________________。
-
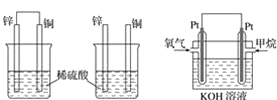
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
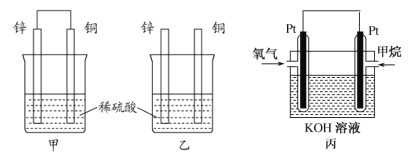
①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
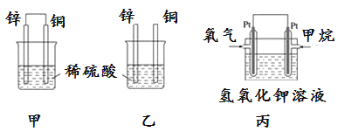
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
②同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
③请写出甲乙图中构成原电池的负极电极反应式:__________________。
④当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
(2) 图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出负极的电极反应方程式为____________________________________。
-
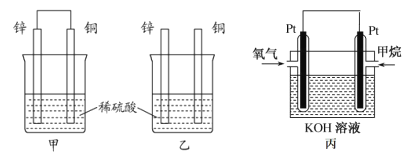
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
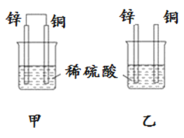
(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.甲乙两烧杯中溶液的 pH 均增大
(2)同条件下两烧杯中产生同体积的气体,需要的时间甲________乙(填“>”“<”或“=”)。
(3)请写出甲乙图中构成原电池的负极电极反应式:__________________。
(4)当甲中溶液质量增重15.75g时,电极上转移电子数目为______________。
(5)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。写出正极的电极反应方程式为_________。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl = NaCl + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A.________B.________。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是(填“锌”或“铜”),发生________反应(填“氧化”或“还原”);
②正极的电极反应式为________;
③产生这些气体共需转移电子________mol。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑上述反应中能设计成原电池的是______。
(2)将纯锌片和纯铜片按图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲_______乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式_________________________。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为____________________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入_____________极(填a或b),电子从 __________(填a或b)极流出。
-
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
(1)现有如下两个反应:
A.NaOH+HCl=NaCl+H2O,
B.2FeCl3+Cu=2FeCl2+CuCl2
判断能否设计成原电池A.________B.________.(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体.
①负极是________(填“锌”或“铜”),发生________反应(填“氧化”或“还原”);
②正极的电极反应式为________;
③产生这些气体共需转移电子________mol.