-
辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
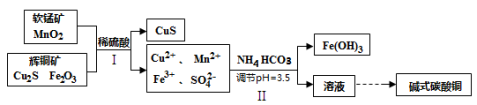
① 步骤I中用稀硫酸浸取矿石,为提高浸取率可采取的措施有 (任写一种)。
② 步骤Ⅱ中调节浸出液pH=3.5的作用是 ;
③ 步骤Ⅰ中发生如下3个反应,已知反应Ⅰ中生成的硫酸铁起催化作用。请写出反应Ⅲ的化学方程式。
Ⅰ.Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
Ⅱ.Cu2S+ Fe2(SO4)3 = CuSO4+CuS+2FeSO4
Ⅲ. 。
④步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 。
-
铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑ 该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑ 该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
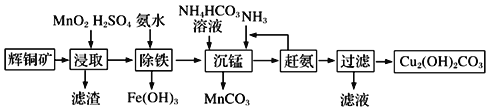
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
-
黄铜矿(CuFeS2)是提取铜的主要原料,其煅烧产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2…①;2Cu2O+Cu2S→6Cu+SO2…②.则
A.反应①中还原产物只有SO2
B.反应②中Cu2S只发生了氧化反应
C.将1 molCu2S冶炼成 2mol Cu,需要O21mol
D.若1molCu2S完全转化为2molCu,则转移电子数为2NA
-
利用辉铜矿冶炼铜时发生的主要反应为Cu2S+O2 2Cu+SO2,下列有关该反应的说法正确的是
2Cu+SO2,下列有关该反应的说法正确的是
A. 硫元素被氧化 B. O2发生了氧化反应
C. Cu2S仅作还原剂 D. 反应中Cu元素无电子转移
-
(13分)金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
A.Fe2O3 B.NaCl C.Cu2S D.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。
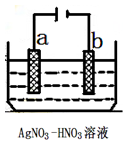
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成的该气体为 ,电极反应为 。
-
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 ,
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2==4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)下图为电解精炼银的示意图, (填“a”或“b”)极为含有杂质的粗银,若b极 有少量红棕色气体产生,则生成该气体的电极反应式为 ,

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
-
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应 2Cu2S+2H2SO4+5O2==4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
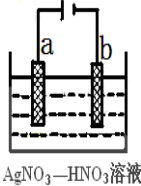
(4)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
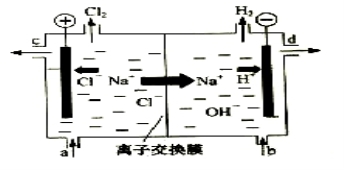
完成下列填空:
写出电解饱和食盐水的离子方程式 。
离子交换膜的作用为: 、 。
精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
-
金属冶炼和处理常涉及氧化还原反应.
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol.向CuSO4溶液中加入镁条时有气体生成,该气体是
(3)下图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为
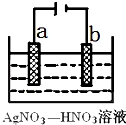
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 .
-
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是___________
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2H2O,该反应的还原剂是___________,当1mol O2发生反应时,还原剂所失电子的物质的量为___________mol.向CuSO4溶液中加入镁条时有气体生成,该气体是___________;
(3)右图为电解精炼银的示意图,___________(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则b极上发生反应的类型是___________(填“氧化反应”或“还原反应”)。
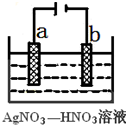
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为___________。
-
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中,正确的是 ( )
A. Cu既是氧化产物又是还原产物 B. 该反应的氧化剂只有Cu2O
C. Cu2S在反应中既是氧化剂,又是还原剂 D. 每生成19.2gCu,反应中转移0.6mol电子






