-
某化学小组的同学模拟工业制硝酸设计了如下图所示的装置。
已知:CaCl2+nH2O→CaCl2•nH2O;CaCl2+8NH3→[Ca(NH3)8]Cl2
根据题意完成下列填空:
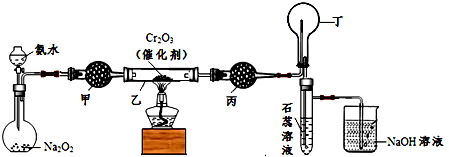
(1)分液漏斗中氨水的浓度为9.0mol/L.现用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有___________(选填编号)。
a.100mL容量瓶 b.10mL量筒 c.50mL量筒 d.电子天平
(2)受热时,乙中反应的化学方程式为_____________________。
(3)实验开始先加热催化剂,当催化剂达红热时再打开分液漏斗活塞并移走酒精灯,可观察到的现象有:乙中Cr2O3仍能保持红热状态;丁的烧瓶中气体由___ ____色转化为______色;试管里的石蕊试液______________;
(4)丙中盛放的药品为_________________(选填下列编号),其目的是_______________。
a.浓H2SO4 b.无水CaCl2 c.碱石灰 d.无水CuSO4
(5)丁中除了NO之外,还可能存在的气体有_______________(填写化学式)。烧杯中可能发生的反应的化学方程式___________________、_________________。
-
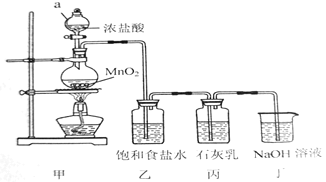
某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。
已知:
①氯气和碱反应放出热量。
②6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O
请回答下列问题。
(1)甲装置中仪器a的名称是___。
(2)圆底烧瓶内发生反应的化学方程式为___;装置乙中饱和食盐水的作用是___。
(3)装置丁中发生反应的离子方程式为___。
(4)漂白粉在空气中失效的原因是___、___(用化学方程式表示)。
(5)①该小组制得的漂白粉中n(CaCl2)远大于n[Ca(C1O)2],其主要原因是___。
②为提高Ca(ClO)2的含量,可采取的措施是___(任写一种即可)。
-
某兴趣小组模拟工业制漂白粉,设计了如下图所示的实验装置。己知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2 5CaCl2+Ca(ClO3)2+6H2O
5CaCl2+Ca(ClO3)2+6H2O

回答下列问题:
(1)甲装置中仪器a的名称是_________________,MnO2在反应中所起的作用是_____________。
(2)装置乙中饱和食盐水的作用是_________________。
(3)①制取漂白粉的化学方程式是____________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],其主要原因是____________________。
③为提高Ca(ClO)2的含量,可采取的措施是___________________(任写一种即可)。
(4)漂白粉应密封保存,原因是__________、_________________(用化学方程式表示)。
-
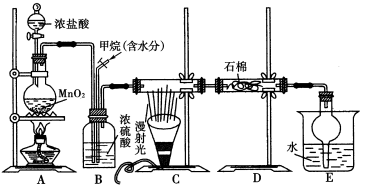
利用甲烷和氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下图所示:
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②干燥混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应____________。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:____________________________________。
(4)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为___________。该装置的主要缺陷是 。
(5)已知丁烷与氯气的取代反应的产物之一为C4H8Cl2,其有 种同分异构体。
-
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下图所示:

根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应____________。
(3)E装置的作用是____________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_______________________________________。
(5)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为____________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4
-
(10分)利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
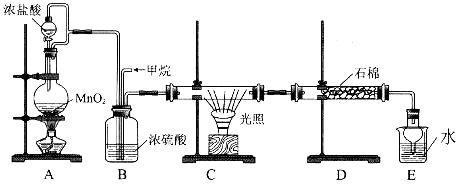
(1)A中制取C12反应的化学方程式是_____________________________。
(2)D装置中的石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(3)E装置的作用是______________(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(4)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(5)将l mol CH4与C12发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
-
回答下列问题:
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
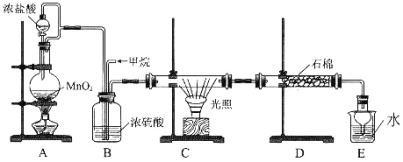
(1)最简单烷烃的空间结构为_______________。
(2)写出装置C中生成一氯甲烷的化学方程式:__________,该反应类型为:_________。
(3)D中石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(4)若题目中甲烷与氯气的体积之比为1∶1,两者反应则得到的产物有____种,其中常温下为气态的有机产物的化学式为:________。
(5)将0.4molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
(6)烃A为甲烷的同系物,A中有12个氢原子,写出A的同分异构体中,含4个-CH3的结构简式: _________。
-
为了探究化学能与热能的转化,某实验小组设计了如下图所示的三套实验装置:
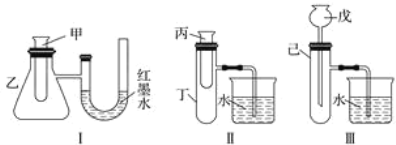
(1)上述3个装置中,不能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是________(填装置序号)。
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了Ba(OH)2溶液与稀硫酸,U形管中可观察到的现象是_________________________________。说明该反应属于________(填“吸热”或“放热”)反应。
(3)为探究固体M溶于水的热效应,选择装置Ⅱ进行实验(反应在丙试管中进行)。
①若M为钠,则实验过程中烧杯中可观察到的现象是_________________。
②若观察到烧杯中产生气泡,则说明M溶于水________(填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”),理由是_________________________________________。
(4)至少有两种实验方法能验证超氧化钾与水的反应(4KO2+2H2O===4KOH+3O2↑)是放热反应还是吸热反应。
方法①:选择装置________(填装置序号)进行实验;
方法②:取适量超氧化钾粉末用脱脂棉包裹并放在石棉网上,向脱脂棉上滴加几滴蒸馏水,片刻后,若观察到脱脂棉燃烧,则说明该反应是________(填“吸热”或“放热”)反应。
-
为了探究化学能与热能的转化,某实验小组设计了如下图所示三套实验装置:
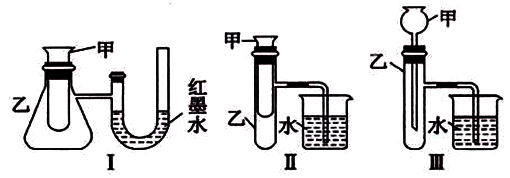
(1)图示3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是______。
(2)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管里先加入适量氢氧化钡溶再加入稀硫酸,U形管中可观察到的现象______,说明该反应属于________(填‘吸热”或“放热”)反应。
(3)为探究固体M遇水的热效应,选择装罝Ⅱ进行实验,先在甲中放入适量的水,再加入M。
①若M为钠,则实验过程中烧杯中可观察到的现象是________。
②若只观察到烧杯里的玻璃管内形成一段水柱,则M可能是 ________。
-
(12分)某课外小组模拟工业流程,设计了如下实验装置制备硝酸(所有橡胶制品均已被保护)。
(1)分别写出工业上用氨气制取NO及实验室用浓硝酸制取NO 的化学方程式:______________;___________________。
的化学方程式:______________;___________________。
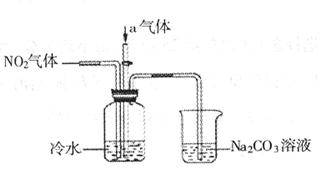
(2)连接好该装置后,首先进行的操作是:_____________________。
(3)通入的气体a是______________(填化学式),通入a的目的是:___________。
(4)盛有Na CO
CO 溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是:
_______NO +_______Na
+_______Na CO
CO +_______H
+_______H O=NaNO
O=NaNO +_______+_______NaHCO
+_______+_______NaHCO (完成此方程式)
(完成此方程式)
(5)用N O
O 代替NO
代替NO 与水和a气体反应可生成硝酸,此反应的化学方程式是:
与水和a气体反应可生成硝酸,此反应的化学方程式是:
____________________________________。









