-
CO2的转换在生产、生活中具有重要的应用。
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”。
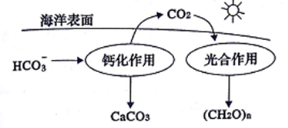
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为_________、___________________。
②在海洋碳循环中,可通过上图所示的途径固碳。写出钙化作用的离子方程式:____________。
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2  2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。
(3) 目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5molCO2和1.5 mol H2转化率达80%时的能量变化示意图。能判断该反应达到化学平衡状态的依据_______(填字母)。
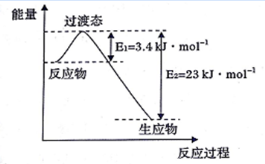
a.容器中压强不变 b.H2的体积分数不变
c.c(H2 =3c(CH3OH) d.容器中密度不变
e. 2个C = O断裂的同时有6个H - H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g) +H2(g),得到如下三组数据:
CO2(g) +H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min |
| CO | H2O | H2 | CO |
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| | | | | | |
①实验2条件下平衡常数K=____________。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值_________ (填具体值或取值范围)。
③ 实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正____v(逆)(填“ <”、“ >”或“=")。
(5)已知在常温常压下:
①2CH3OH(I) +3O2(g)=2CO2(g) +4H2O(g) △H= -1275.6 kJ • mol-1
②2CO(g) +O2(g)=2CO2(g) △H = -566.0 kJ·mol-1
③H2O(g)=H2O(I) △H =-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____________。
-
CO2的转换在生产、生活中具有重要的应用。
Ⅰ.CO2的低碳转型对抵御气候变化具有重要意义。
(1)海洋是地球上碳元素的最大“吸收池”。
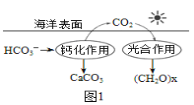
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为____________。
②在海洋碳循环中,可通过下图所示的途径固碳。写出钙化作用的离子方程式:_____________。
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2  2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
Ⅱ.环境中的有害物质常通过转化为CO2来降低污染。
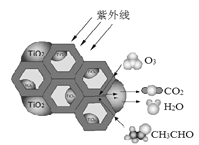
(3)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为____。
(4)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。
①用丙酮浸泡的目的是______。
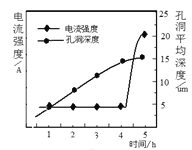
②电解时,电流强度和基板孔洞深度随时间变化如图所示,氧化的终点电流突然增加的原因是______。
-
碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
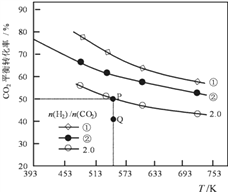
在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g)  C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
| 化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
| 键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
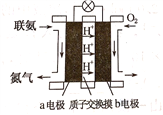
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
-
碳的化合物的转换在生产、生活中具有重要的应用,如航天员呼吸产生的CO2用Sabatier反应处理,实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g);
CH4(g)+2H2O(g);
水电解反应:2H2O(1)  2H2(g) +O2(g)。
2H2(g) +O2(g)。
(1)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①该反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为_______。(不必化简,用平衡分,压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化率的是____(填标号)。
A.适当减压 B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
(3)一种新的循环利用方案是用Bosch反应CO2(g)+4H2(g) C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ/mol、-242kJ/mol,Bosch反应的△H=_____kJ/mol。(生成焓指一定条件下由对应单质生成lmol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是______________。若使用催化剂,则在较低温度下就能启动。
③Bosch反应的优点是_______________。
-
CO2是温室气体,研究CO2的应用对促进低碳生活具有重要意义。
(1)1922年德国工业化生产尿素
Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1=-159.50kJ·mol-1
NH2COONH4(s) ΔH1=-159.50kJ·mol-1
Ⅱ:NH3COONH4(s)  CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
CO(NH2)2(s)+H2O(g) ΔH2=+72.50kJ·mol-1
①写出用NH3和CO2合成尿素总反应的热化学方程式_________;按照酸碱质子理论,能接受H+的物质为碱,现常温下溶液中存在反应:NH3+NH2COOH NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
NH2COONH4(K=1×1010),则该溶液中碱性强弱为:NH3____NH2COONH4(填“强于”、“弱于”、“相等”或“不能确定”)。
②在一个体积恒为1L的恒温密闭容器中充入2molCO2和4molNH3的混合气体,经历反应Ⅰ、Ⅱ合成CO(NH2)2,混合气体中的氨气体积分数及气体总浓度随时间变化如下图所示。

对于反应Ⅰ:A点的正反应速率与B点的逆反应速率的大小关系是:v _______v
_______v (填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
(填“>”“<”或“=”)。当温度升高时,平衡常数K1值的变化趋势为__________,在B点氨气的转化率为_________;
对于反应Ⅱ:从动力学分析,选用合适正催化剂可以使该反应活化能_______(“增大”“减小”或“不变”)
(2)利用二氧化碳制备乙烯
用惰性电极电解强酸性二氧化碳水溶液可得到乙烯,其原理如下图所示。

①b电极上的电极反应式为______________;
②该装置中使用的是___________(填“阴” 或“阳”)离子交换膜。
-
氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72- + NO2- + → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
-
I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)碳元素原子核外有_____个未成对电子,最外层有_____种能量不同的电子。CH4 分子的空间构型为_____,是_____分子。(填“极性”或“非极性”)
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_____(填编号)
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸是强酸,硅酸是弱酸 d.碳原子半径比硅原子小
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K_____。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施_____、_____。
(3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_____。
-
碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
(1)自然界中的碳循环对人类的生存与发展具有重要意义。
①绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:_________________。
②溶洞的形成是石灰岩中的主要成分碳酸钙在一定条件下溶解和沉积形成,请站在活化能的角度解释溶洞形成过程极为缓慢的原因____________。
(2) 工业上碳及其化合物是重要的工业原料。
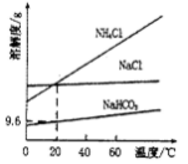
①以CO2、NaCl、NH3为原料制得Na2CO3是“侯氏制碱法”的重要步骤,相关物质的溶解度曲线如图所示,请写出常温下向饱和氯化钠溶液中先后通入足量的NH3、CO2发生反应的离子方程式:___。
常温常压下,在NaHCO3溶液中存在如下平衡:
HCO3-+H2O H2CO3+OH- Kh=2.27×10-8
H2CO3+OH- Kh=2.27×10-8
HCO3-  CO32-+H+ Ka2=4.7×10-11
CO32-+H+ Ka2=4.7×10-11
H2O H++OH- Kw=1.0×10-14
H++OH- Kw=1.0×10-14
请用K定量解释NaHCO3溶液显碱性的原因:____________,在NaHCO3溶液中继续通入CO2,至溶液中n(HCO3-):n(H2CO3)= ____________时溶液可以达中性。
②工业上可以利用甲醇制备氢气。
甲醇蒸汽重整法制备氢气的胡政尧反应为CH3OH(g)  CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为__________________。
CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为__________________。
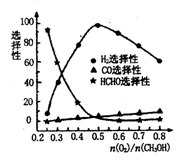
工业上还可以利用甲醇部分氧化法制备氢气,在一定温度下以Ag/CeO2-ZnO为催化剂,原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图所示.则当
n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为__________;在制备H2时最好控制n(O2)/n(CH3OH)=________。
-
2016年11月4日市《巴黎协定》气候协议生效的日期,其宗旨是提高绿色低碳转型的竞争力,抵御气候变化。下列行为不符合宗旨的是
A. 倡导上下班尽全乘公交车出行
B. 将CO2合成有价值的化学品
C. 提高风能、太阳能等可再生清洁能源的使用比例
D. 加快化石燃料的开采与使用,满足经济发展需求
-
18.(14分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。

(2)已知:N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+ O2(g)=CO2(g)的△H=________kJ·mol-1
O2(g)=CO2(g)的△H=________kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为________,平衡时H2的转化率为________%,该反应的平衡常数K=________(mol·L-1)-2.
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 m01.则前5分钟的平均反应速率v(N2)为________,平衡时H2的转化率为________%,该反应的平衡常数K=________(mol·L-1)-2.
(4)在固定体积的密闭容器中.1.0×103kPa时反应N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
则K1________K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是________(填字母)
a.容器内N2、H2、NH3的浓度之比为I:3:2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变

2Na2CO3+C。放电时,在正极得电子的物质为___________;充电时,阳极的反应式为___________。

CO2(g) +H2(g),得到如下三组数据:










