-
(18分)(一)按要求作答:
(1)第四周期中,未成对电子数最多的原子,其外围电子排布式为:________。
(2)3d能级为半充满的正三价离子,该离子的电子排布式为________。
(二)A、B、C、D、E五种元素为1~18号元素。已知:它们的原子序数依次增大,A、B两种元素的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2;C元素原子的电子层数及最外层电子数都比E元素的少1;D和E的原子序数之和为30。它们两两形成的化合物有甲、乙、丙、丁四种。这四种化合物中原子个数比如下表:
甲 乙 丙 丁
化合物中各元素原子个数比 A和C 1∶1 B和A 1∶2 D和E 1∶3 B和E 1∶4
(1)E-的结构示意图是________________。B原子核外有________个未成对电子,它们的能量______________(填“相等”或“不相等”)。
(2)向甲的水溶液中加入MnO2可用于实验室制备C的单质,其化学方程式是____________________。
(3)已知有机物乙的分子为平面结构,键角都为120°,它的结构简式为___________。
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量的气体和难溶物,有关离子方程式是____________________。
高二化学填空题困难题查看答案及解析
-
按下列要求作答。
(1)第二周期中,第一电离能介于B和N之间的元素共有_________种。
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有_________种。
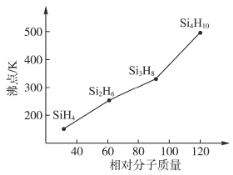
(3)硅烷(Si,H2H2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___________________________。
高二化学综合题中等难度题查看答案及解析
-
A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
元素
相 关 信 息
A
原子核外有7种运动状态不同的电子
B
外围电子排布式为nsnnpn+2
C
常见的金属,在周期表中周期序数与族序数相等
D
气态氢化物及最高价氧化物对应的水化物均为强酸
E
一种核素的质量数为56,中子数为30
F
单质紫红色,电缆材料,常见氧化物为黑色
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
高二化学推断题困难题查看答案及解析
-
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐.
(1)铬是一种硬而脆,抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,电子占据最高能层的符号为 ,该能层上具有的原子轨道数为 ,电子数为 .
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律? (填“是”或“否”),原因是 (如果前一问填“是”,此问可以不答).
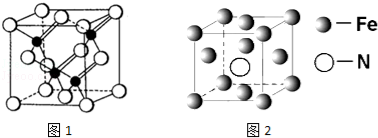
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与 个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为 .
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型 ,一定压强下将AsH3和NH3、PH3的混合气体降温是首先液化的是
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为 ;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为 g.cm﹣3(用含a和NA的式子表示)
高二化学填空题简单题查看答案及解析
-
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态 Cr 原子中,电子占据最高能层的符号为______,该能层上具有的原子轨道数为________,价电子排布式为 ____________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga 的第一电离能是否符合这一规律?________(填“是”或“否”),原因是____________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA 族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表 As 原子)。在 GaAs 晶体中,每个 Ga 原子与________个 As 原子相连,与同一个 Ga 原子相连的As原子构成的空间构型为________。

(4)铜单质晶体中原子的堆积方式如下图,已知铜晶胞参数为apm,NA为阿伏加德罗常数,请回答:
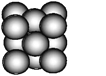
①晶体中铜原子的配位数为________,堆积方式为________________堆积。
②铜原子半径r=_________pm;铜晶体密度的计算式为 ______________ g/cm3(注:铜原子相对原子质量为64)。
③Cu 与 N 按3:1形成的某种化合物,该化合物能与稀盐酸剧烈反应,生成一种白色沉淀和一种全部由非金属元素组成的离子化合物,该反应的化学方程式为______________。
高二化学综合题中等难度题查看答案及解析
-
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为________,该能层上具有的原子轨道数为________,电子数为________。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?________(填“是”或“否”),原因是_______________________________(如果前一问填“是”,此问可以不答)。
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与________个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为________。

(4)与As同主族的短周期元素是N、P、AsH3中心原子杂化的类型________;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是________,理由是________________________。
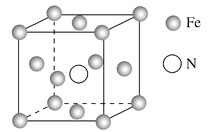
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为________;设晶胞边长为a cm,阿伏加德罗常数的值为NA,该晶体的密度为________ g·cm-3(用含a和NA的式子表示)。
高二化学填空题中等难度题查看答案及解析
-
第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)钛原子的价电子排布式为______________________,TiCl4沸点136℃,熔点-25℃,晶体类型为___________晶体。
(2)铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是______________________。
(3)与As同主族的短周期元素是N、P。AsH3中心原子轨道杂化的类型_________________;一定压强下将AsH3、NH3和PH3的混合气体降温时液化顺序是______________________,理由是______________________。
(4)铬是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图1为铬的晶胞结构图,则铬晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。

(5)钴晶体的一种晶胞(如图2所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则钴原子半径为___________mm,钴的相对原子质量可表示为___________。
高二化学综合题中等难度题查看答案及解析
-
已知A、B、C、D、E、F、G为前四周期中的常见元素,且原子序数依次增大,A的原子半径最小;B的基态原子L层电子数是K层电子数的2倍;C与B同周期且基态原子最外层电子排布式为nsmnpm+2;D、E、F、G是位于同一周期的金属元素,元素D的焰色反应要透过蓝色钴玻璃才能观察到紫色;且D、G的原子序数相差10;E元素有多种化合价,它的一种氢氧化物在空气中易被氧化且最终变为红褐色,且E、F的电子数相差1。
请回答下列问题:
(1)基态E原子的价电子排布式为___。
(2)与BC分子互为等电子体的离子为___ (填化学式,任写一种)。
(3)在液态非极性分子B6A6中,B原子采取的杂化方式为___。
(4)元素C的简单氢化物的沸点比同主族的简单氢化物都高的原因是___。
(5)F可形成化学式均为F(NH3)5BrSO4的两种配合物,其中一种化学式为[F(NH3)5Br]SO4。向另一种配合物的溶液中加入BaCl2溶液时,无明显现象。若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
(6)金属D、G晶体的晶胞结构如图所示。
①金属G的晶胞中,测得晶胞中G原子的半径为apm,则G晶体的密度为___g/cm3(列出表达式即可,NA为阿伏伽德罗常数的值),D、G两种晶胞中金属的配位数之比为___。


②金属G、锌两种元素的笫一电离能、第二电离能如下表所示:
电离能/kJ·mol-1
I1
I2
G
746
1958
锌
906
1733
G的第二电离能(I2)大于锌的第二电离能(I2),其主要原因是___。
高二化学综合题中等难度题查看答案及解析
-
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素
相关信息
A
基态原子的价电子排布式为nSnnPn
B
元素原子的核外p电子数比s电子数少1个
C
最外层电子数是电子层数的3倍
D
简单离子是第三周期元素中离子半径最小的
E
价电子层中的未成对电子数为4
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
高二化学综合题中等难度题查看答案及解析
-
A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素
相关信息
A
基态原子的价电子排布式为nSnnPn
B
元素原子的核外p电子数比s电子数少1个
C
最外层电子数是电子层数的3倍
D
简单离子是第三周期元素中离子半径最小的
E
价电子层中的未成对电子数为4
请回答下列问题:
(1)写出下列元素符号:A______, B_______,C________,D__________。
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式______________,B元素能量最高的电子为____轨道上的电子,其轨道呈______形。
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。(阿伏加德罗常数的值用NA表示)
(4)B、C、D的简单离子的半径由大到小的顺序为________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
高二化学推断题中等难度题查看答案及解析