-
碱金属钠及其化合物广泛应用于医药、工农业生产和化工领域。回答下列问题:
(1)碱金属的焰色反应及霓虹灯光、激光等现象与原子核外电子发生_________有关。电子排布式为1s22s22p63s23p54s2是_________(填元素符号)原子的_________态原子。
(2)钠形成的化合物均为离子化合物,原因是___________________________。
(3)钠的有机盐是一类重要的钠盐,如丙酸钠(CH3CH2COONa)和氨基乙酸钠(H2NCH2COONa)。
①CH3CH2COO−中均为共价键,共价键类型有σ键和π键,σ键与π键的个数比为_________;H2NCH2COO−中N原子的杂化轨道类型为_________,C原子的杂化轨道类型为_________。
②丙酸钠和氨基乙酸钠均能水解,水解产物有丙酸和氨基乙酸,二者部分数据如下表:
| 熔点/℃ | 沸点/℃ | 水溶解性 |
| 丙酸 | −21.5 | 141.1 | 能与水混溶 |
| 氨基乙酸 | 186 | 234 | 易溶于水 |
由熔点数据可知,常温下丙酸为液体,而氨基乙酸为固体,主要原因是__________________,二者均易溶解于水,而相对分子质量与其相差不大的戊烷却难溶于水,原因是__________________。
(4)Na2O晶胞结构如图所示,其中钠为_________(选填“甲”或“乙”),其晶胞参数a=0.566 nm,则Na2O的密度为_________________g·cm−3。(列式即可,不必计算出结果,NA =6.02×1023 mol−1)
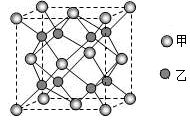
-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
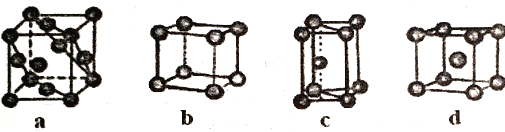
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
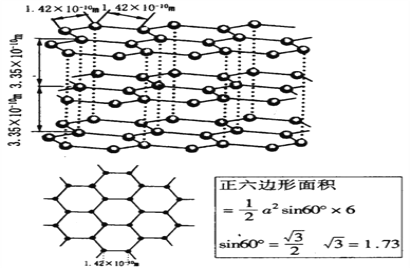
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_________________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是_______________________。
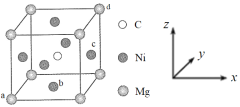
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为______________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
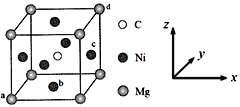
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为______________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
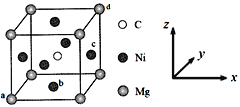
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为______________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
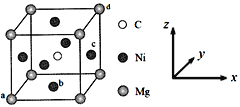
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
-
金属及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)下列关于金属及金属键的说法不正确的是______。(填字母代号)
a.金属键没有方向性与饱和性
b.金属键是金属原子与自由电子间的相互作用
c.金属熔沸点不同的原因可以用金属键强弱解释
d.电子气理论可解释金属材料的延展性,不能解释金属有良好的导电性
(2)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为______________。
(3)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173 ℃,100 ℃以上升华,二茂铁属于_____晶体。已知分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 )。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
)。已知二茂铁的每个茂环带有一个单位负电荷,则每个环中的大π键应表示为________________。
(4)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行______实验,其中阴离子的空间构型是_____,该化合物加热时首先失去的组分是H2O,原因是________。
(5)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。
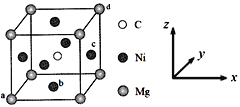
①与Mg紧邻的Ni有________个。
②原子坐标参数可表示晶胞内部各原子的相对位置。该晶胞中原子的坐标参数为a为(0,0,0);b为(1/2,1/2,0);d为(1,1,1)。则c原子的坐标参数为_______。
③若晶胞中Ni、Mg之间的最短距离为a pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g·cm-3(用含a、NA的代数式表示)。
-
锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045 V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因__________。
(2)基态氮原子中,核外电子占据的最高能层的符号为_______,核外电子能量最高的电子的电子云轮廓图形状为_________。
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为__________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如N5AsF6中存在高能量的N5+,N5+的空间构型为_______。(每个N原子都满足8电子稳定结构)
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中画出其晶胞_____,并写出该化合物的化学式_________。

-
锂和氮的相关化合物在化工、医药、材料等领域有着广泛的应用。请回答下列问题
(1)Li的氢标电势是最负的,达到-3.045V,与水有很大的反应倾向,然而将Li单质加入水中,其反应烈程度远不如其他碱金属,试解释原因___________________________
(2)基态氮原子中,核外电子占据的最高能层的符号为____________,核外电子能量最高的电子的电子云轮廓图形状为____________
(3)氮元素既可与其他元素形成正离子,比如N2O5结构中存在NO2+的结构,其空间构型为____________,氮原子的杂化形式为____________;它也可以形成全氮的正离子,比如 N5AsF6中存在高能量的N5+,N5+的空间构型为____________。
(4)下图为一种N和Li形成的二元化合物的晶体结构,试在图中划出其晶胞__________,该化合物的化学式为____________
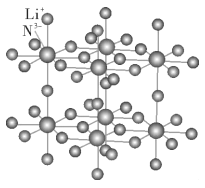
-
金属钛(22Ti)、铁(26Fe)及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为_____________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_________种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_____________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C N)和异硫氰酸(H-N=C=S)。
N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为______________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是__________________________________。
(4)TiCl3可用作烯烃定向聚合的催化剂,如:nCH3CH=CH2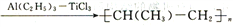 。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
(5)Ti 的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+ 位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围________个O2-紧邻;若该晶胞的密度为dg/cm3 则钛氧键的键长为________cm(用含NA 的代数式表示)。
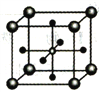










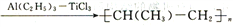 。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。
。该反应涉及的物质中碳原子的杂化轨道类型有_______________________;反应涉及的元素中电负性最大的是_____________________________。