-
硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)已知:①2H2Se(g)+O2(g) 2Se(s)+2H2O(l) ΔH1=a kJ·mol−1
2Se(s)+2H2O(l) ΔH1=a kJ·mol−1
②2H2(g)+O2(g)= 2H2O(l) ΔH2=b kJ·mol−1
反应H2(g)+Se(s) H2Se(g)的反应热ΔH3=___________kJ·mol−1(用含a、b的代数式表示)。
H2Se(g)的反应热ΔH3=___________kJ·mol−1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s) H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是___________(填字母)。
a.气体的密度不变 b.υ(H2)=υ(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释_________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如下图所示:
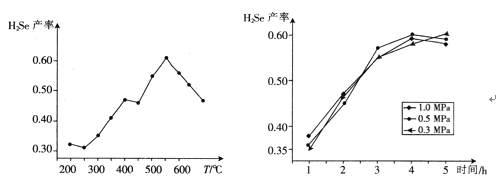
则制备H2Se的最佳温度和压强为______________________。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10−4,K2=5.0×10−11,则NaHSe溶液呈___________(填“酸性”或“碱性”),该溶液中的物料守恒关系式为____________________。
(4)用电化学方法制备H2Se的实验装置如下图所示:

写出Pt电极上发生反应的电极反应式:_________________________________。
(5)H2Se在一定条件下可以制备CuSe,已知常温时CuSe的Ksp=7.9×10−49,CuS的Ksp=1.3×10−36,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
-
硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s) H2Se(g)。
H2Se(g)。
①当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释___。
-
2018年9月26日,第五届硒博会在恩施州文化中心大剧院开幕。第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)  2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2 (g)+O2(g 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1
反应H2(g)+ Se(s)  H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是_______(填字母代号)。
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:________________________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
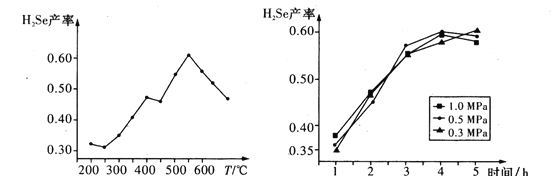
则制备H2Se的最佳温度和压强为________。
(3)已知常温下H2Se的电离平衡常数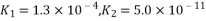 ,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________,最后通入SO2析出硒单质。
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9 ,CuS的
,CuS的 ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
-
2018年9月26日,第五届硒博会在恩施州文化中心大剧院开幕。第五届硒博会主题为“健康中国·硒引天下”。硒(Se)是第四周期第VI A族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)  2Se(s)+2H2O(l) △H =a kJ·mol-1
2Se(s)+2H2O(l) △H =a kJ·mol-1
②2H2 (g)+O2(g 2H2O(l) △H=b kJ·mol—1
2H2O(l) △H=b kJ·mol—1
反应H2(g)+ Se(s)  H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的反应热△H=______kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1 mol Se,发生反应H2 (g)+Se(s) H2Se(g),
H2Se(g),
①下列情况可判断反应达到平衡状态的是_______(填字母代号)。
a. 气体的密度不变 b. v(H2) =v(H2Se)
c. 气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:________________________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
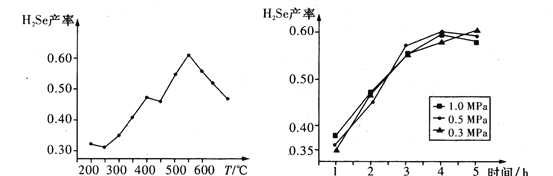
则制备H2Se的最佳温度和压强为________。
(3)已知常温下H2Se的电离平衡常数 ,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
(4)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为___________,最后通入SO2析出硒单质。
(5) H2 Se在一定条件下可以制备出CuSe,已知常温时CuSe的Ksp=7.9 ,CuS的
,CuS的 ,则反应CuS(s)+Se2-(aq)
,则反应CuS(s)+Se2-(aq) CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=_____ (保留2位有效数字)。
-
下列叙述正确的是( )
A. 铅位于元素周期表中金属元素与非金属元素交界处,可作半导体材料
B. 若存在简单阴离子R2-,则R一定属于第ⅥA族元素
C. S和Se属于第ⅥA族元素,H2S的还原性比H2Se的强
D. 最外层电子数为1的元素一定属于第ⅠA族元素
-
硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:

(1)硒在元素周期表中的位置________________________。
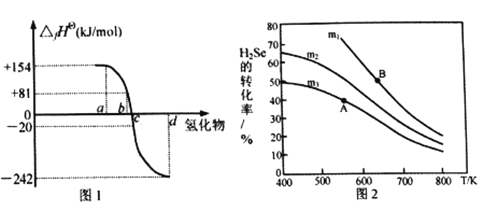
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g)  2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g)  2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq)  CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
-
硒(Se)是第34号元素,是人体内不可或缺的微量元素,可以形成H2Se、SeO2、H2SeO3、H2SeO4、CuSe等多种化合物。请回答下列问题:
(1)硒在元素周期表中的位置________________________。
(2)在101kPa、一定温度(一般是298K)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的标准生成热(△fHθ)。图1为氧族元素氢化物a、b、c、d呈气态时的生成热数据。
①图1中氢化物d的电子式为__________________________。
②在298K时,硒化氢分解反应的热化学反应方程式为__________________________。
③由图中数据计算,2H2Se(g)+O2(g)  2Se(s)+2H2O(g) △H=_____________KJ/mol
2Se(s)+2H2O(g) △H=_____________KJ/mol
(3)在恒容反应器中,将H2Se(g)和O2(g)按不同比例[n(H2Se)/n(O2)=m]投入反应器,测得反应2H2Se(g)+O2(g)  2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
2Se(s)+2H2O(g)中H2Se的平衡转化率随温度变化如图2所示。则A、B两点平衡常数大小关系为KA________KB(填“<”、“>”或“=”),图中m1、m2、m3由大到小的顺序为 ____________,理由是____________________________________。
(4)常温下溶度积:Ksp(CuSe)=7.9x10-49,Ksp(CuS)=1.3×10-36。则反应CuS(s)+Se2-(aq)  CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
CuSe(s)+S2-(aq)的化学平衡常数K为____________(结果用科学记数法表示,并保留2位小数)。当溶液中c(S2-)=100c(Se2-)时,反应中v(正)_____v(逆)(填“<”、“>”或“=”) 。
-
元素周期表中VIA族2~5周期元素分别为氧(O)、硫(S)、硒(Se)、碲(Te),它们的单质与H2反应生成1mol气态氢化物的反应热如下。其中表示生成1mol硒化氢(H2Se)反应热的是
A.+99.7kJ·mol-1
B.+29.7kJ·mol-1
C.-20.6kJ·mol-1
D.-241.8kJ·mol-1
-
“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是
A.ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O
B.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3
C.工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质
D.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生
-
下列叙述错误的是 ( )
(1)所有的碱性氧化物都是金属氧化物
(2)H2S水溶液是弱酸,HCl水溶液是强酸,可以验证硫元素的非金属性比氯元素弱
(3)H2O、H2S、H2Se的相对分子质量增大,所以熔沸点依次升高
(4)液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
(5)都是由非金属元素形成的化合物只能是共价化合物
A.全部 B.(1)(2)(3)(4)
C.(1)(2)(3)(5) D.(2)(3)(4)(5)
2Se(s)+2H2O(l) ΔH1=a kJ·mol−1
H2Se(g)的反应热ΔH3=___________kJ·mol−1(用含a、b的代数式表示)。
H2Se(g)。


CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。

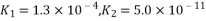 ,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。
,则NaHSe溶液呈_______(填“酸性”或“碱性”),该溶液中的物料守恒关系式为_____________。

