-
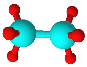
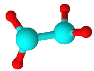
四种短周期元素A、B、C、D原子序数依次递增,原子半径大小: B>C>D>A,四种元素之间两两形成的三种18电子结构的分子,它们的球棍模型及部分性质如下表:
| 甲 | 乙 | 丙 |
| 
| 
| 
|
| 无色液体,具有强氧化性,可用作消毒剂 | 标况下密度约为1.34g/L,天然气中的成分之一 | 液态,具有强还原性,用作火箭推进的燃料 |
(1)写出化学式:甲___________、丙_____________。
(2)元素B核外有________种能量不同的电子,其形成的单质晶体可能是__________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(3)已知1g 液态丙与足量液态甲反应生成氮气和水蒸气,并放出20.05kJ的热量,写出反应的热化学方程式________________。
(4)配平亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式:
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O。
(5)该反应过程较复杂,一般认为分以下几步:
①IO3-+SO32-IO2-+SO42-(反应慢)
②IO2-+2SO32-I-+2SO42-(反应快)
③5I-+6H++IO3-3I2+3H2O(反应快)
④I2+SO32-+H2O2I-+SO42-+2H+(反应快)
根据上述条件推测,此反应速率由________步(填序号)反应决定。
(6)若预先加入淀粉溶液,由反应过程看,必在_______离子消耗完时,才会有溶液变蓝的现象产生。原因是_____________________。
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X的最外层电子数是内层电子数的3倍,W与X位于同一主族,Y、Z、W的最高价氧化物对应水化物两两之间可以反应。下列说法正确的是()
A.原子半径大小X<Y<Z<W
B.阴离子的还原性X>W
C.X分别与Y、W形成的化合物中化学键类型相同
D.四种元素中的某三种形成的盐可能呈酸性、中性或碱性
-
X、Y、Z是原子序数依次递增的短周期元素,3 种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A. 原子半径:Z>Y>X
B. Z 与 X 形成化合物的沸点高于Z 的同族元素与 X形成化合物的沸点
C. CaY2 与水发生氧化还原反应时,CaY2只作氧化剂
D. CaX2、CaY2和CaZ2 等3种化合物中,阳离子与阴离子个数比均为 1∶2
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构.下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到1个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.Na2Y2与水发生氧化还原反应时,Na2Y2只做氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
A.原子半径:Z>Y>X
B.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点
C.Na2Y2与水发生氧化还原反应时,Na2Y2只作氧化剂
D.CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1︰2
-
A、B、C、D、E五种短周期元素的原子序数依次增大,且已知:①其原子半径的大小关系是:D>E>B>C>A;②A、D同主族,可形成离子化合物;③B、D、E三者的最高价氧化物对应的水化物两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;④B、E两元素原子的最外层电子数之和等于A、C、D三种元素原子的最外层电子数之和.请填写下列空白:
(1)常温下,浓度均为0.lmol/L的B、D的最高价氧化物对应的水化物溶液中,水电离出的c(H+)的相对大小关系为X______Y(填写“大于”“于”或“等于”),化合物BA5所属晶体类型为离子晶体,其电子式为______.
(2)在合成BA3的实际生产过程中,常采取______的方法,使气态BA3变成液态后从混合气体中分离出去,以促使化学平衡向生成BA3的方向移动.
(3)E单质与足量的D的最高价氧化物的水化物溶液反应的离子方程式为______;BC2与水反应被氧化与被还原的物质的量之比是______.
(4)已知在298K时,lg B2A4气体燃烧生成B2和A2C气体,放出16.7kJ的热量.该燃烧反应的热化学方程式______.
(5)X、Y分别是B、C与A形成的10电子微粒,请你提供一个能验证X结合H+能力较Y强的离子方程式______.
-
短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是
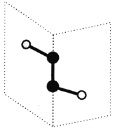
A.原子半径:W > Z > Y > X
B.气态氢化物热稳定性:Y > Z > W
C.元素Z和W均存在两种以上的含氧酸
D.元素Z和W在自然界中均只能以化合态存在



