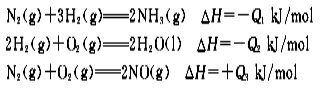-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
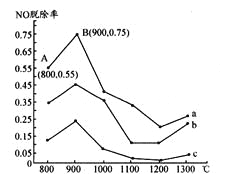
Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图所示。
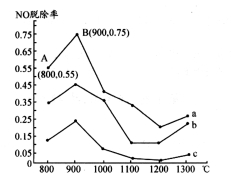
(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为 mg/(m3·s)。
②曲线b对应的NH3与NO的物质的量之比是 ,其理由是
(2)已知在25℃,101kPa时:
N2(g)+3H2(g) === 2NH3(g) △H=-Q1/mol
2H2(g)+O2(g) === 2H2O(1) △H=- Q2kJ/mo1
N2(g) +O2(g) === 2NO(g) △H=+ Q3kJ/mo1
请写出用NH3脱除NO的热化学方程式 。
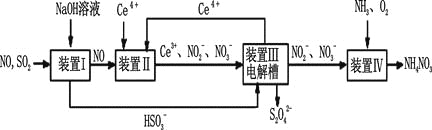
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:
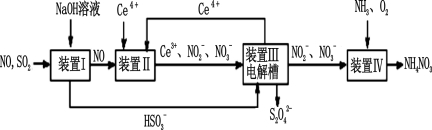
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为 。
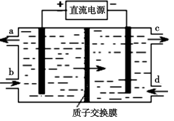
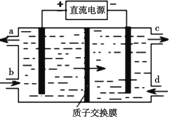
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图所示。其阴极的电极反应式为 : 。
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3。装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2 L(用含a、b的代数式表示)。
-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图所示。
(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
②曲线b对应的NH3与NO的物质的量之比是______,其理由是_________。
(2)已知在25℃,101kPa时:
N2(g)+3H2(g) =2NH3(g) △H=-Q1/mol
2H2(g)+O2(g) =2H2O(1) △H=- Q2kJ/mo1
N2(g) +O2(g) = 2NO(g) △H=+ Q3kJ/mo1
请写出用NH3脱除NO的热化学方程式__________。
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下:
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为__________。
(4)装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图所示。其阴极的电极反应式为 :______。
(5)按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3。装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3-和Ce3+、装置Ⅳ中NO2-全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2____L(用含a、b的代数式表示)。
-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施。
I.研究发现利用NH3可消除硝酸工业尾气中的NO污染。NH3与NO的物质的量之比分别为1:3、3:1、4:1时,NO脱除率随温度变化的曲线如图所示。
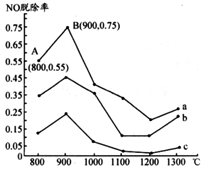
(1)①曲线a中,NO的起始浓度为6×10-4mg/m3,从A 点到B点经过0.8 s,该时间段内NO的脱除速率为____________mg/(m3·s)。
②曲线b对应的NH3与NO的物质的量之比是____,其理由是___________________
(2)已知在25℃,101 kPa时:
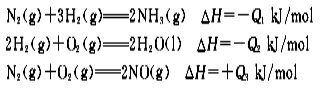
请写出用NH3脱除NO的热化学方程式:____________________________________
Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如下图:
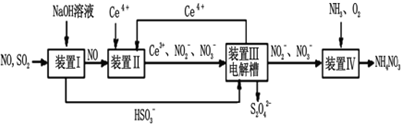
(3)装置Ⅱ中NO转变为NO3-的反应的离子方程式为__________________________________
(4)装置Ⅲ还可以使Ce4+再生,若用甲烷燃料电池电解该装置中的溶液,当消耗1 mol CH4 时,理论上可再生____mol Ce4+。
-
【化学—选修5:有机化学基础】
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。

请回答下列问题:
(1)上述流程中多次设计到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯,_______________;其中玻璃棒的作用是___________________。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是_____________(只用文字表述)
(3)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中惰性电极作阳极,铁作阴极,请写出阳极的电极反应式__________________。
(4)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(5)废气中SO2与稀硫酸酸化的软锰矿反应的化学方程式为_______________;已知废气中SO2浓度为6.4g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000m3燃煤尾气,可得到硫酸锰晶体(MnSO4·H2O,相对分子质量为169)质量为_________________kg(结果保留3 位有效致字)。
-
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
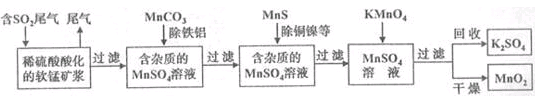
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
-
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
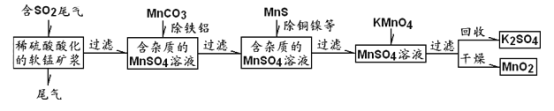
请回答下列问题:
(1)上述流程脱硫实现了______________(选填下列字母编号);
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___________________;
(3)已知: 25℃、101kpa时,
①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
②S(s)+O2(g)=SO2(g) △H=-297kJ/mol
③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是_________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________。
(6)KMnO4溶液与MnSO4溶液反应的离子反应方程式是________。
(7)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2_________kg。
-
大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO 转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) △H2=-221kJ·mol-1
C(s) +O2(g) =CO2(g) △H3=-393.5kJ·mol-1
写出NO(g) 与CO(g)催化转化成N2(g)和CO2(E)的热化学方程式__________________。
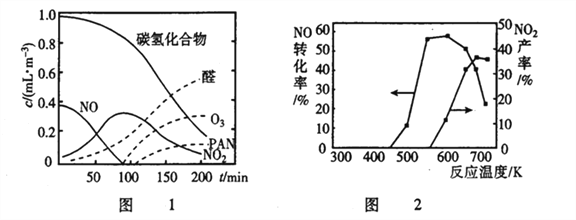
②醛类、O3、PAN( 过氧硝酸乙酰) 等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图 1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议___________________。
(2)利用NH3催化还原氮氧化物(SCR 技术)是目前应用广泛的烟气脱硝技术。
①SCR 技术的主要化学反应之一是2NH3(g)+NO(g)+NO2(g)  2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
2N2(g)+3H2O(g) △H,则该反应的化学平衡常数表达式K=__________。该反应的平衡常数K随温度T的升高而减小,则该反应的△H__________0 (填“>”、“ <”或“”=)。
②SCR技术的另一主要反应为4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO 和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2 产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
4N2(g)+6H2O(g)△H=-1627.2kJ·mol-1。NO 和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700℃,NO转化率明显下降,NO2 产率明显上升(见图2)的可能原因是______________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
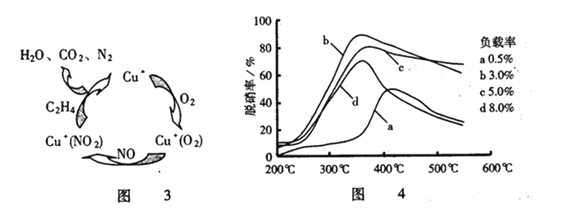
①写出该脱硝原理总反应的化学方程式______________________。
②为达到最佳脱硝效果,应选择的条件是______________________。
-
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液
b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液
d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4•H2O,相对分子质量为169)。已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
-
(16分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程中多次涉及到过滤操作,实验室进行过滤操作时需要用到的硅酸盐仪器有玻璃棒、 、 ;其中玻璃棒的作用是 。
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原理是 。
(3)已知Ksp(CuS)=8.4×10-45,Ksp(NiS)=1.4×10-24;在除铜镍的过程中,当Ni2+恰好完全沉淀 (此时溶液中c(Ni2+)=1.0×10-5mol/L),溶液中Cu2+的浓度是 mol/L。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极,请写出阳极的电极反应式 。
(5)下列各组试剂中,能准确测定一定体积燃煤尾气中SO2含量的是__________。(填编号)
a.NaOH溶液、酚酞试液 b.稀H2SO4酸化的KMnO4溶液
c.碘水、淀粉溶液 d.氨水、酚酞试液
(6)除杂后得到的MnSO4溶液可以通过 (填操作名称)制得硫酸锰晶体(MnSO4•H2O,相对分子质量为169)。已知废气中SO2浓度为8.4 g/m3,软锰矿浆对SO2的吸收率可达90%,则处理1000 m3燃煤尾气,可得到硫酸锰晶体质量为 kg(结果保留3位有效数字)。
-
(12分)污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
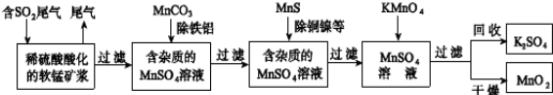
请回答下列问题:
(1)上述流程脱硫实现了 (选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有: 。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是 。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式: ;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是 。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是 。