-
硫化钠是一种重要的化工原料.工业上用硫酸钠来制得硫化钠.制备硫化钠的反应原理为:Na2SO4(s)+4H2(g)⇌Na2S(s)+4H2O(g)﹣Q,已知该可逆反应在1000℃时达到平衡,并保持反应器内恒温恒容.试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为______,若只改变一个影响因素,当平衡移动时,K值______变化(填“一定”或“不一定”);当K值变大时,逆反应速率______.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说法错误的是______.
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe3O4固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.84g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.264g.则10分钟内H2的平均反应速率为______.
(4)往Ba(ClO)2溶液中通入足量SO2气体后,溶液中的溶质是______.
(5)向亚硫酸钠中滴加酚酞,溶液变为红色,若在该溶液中再滴入过量的BaCl2溶液,现象是______,请结合离子方程式,运用平衡原理进行解释:______.
高三化学综合题中等难度题查看答案及解析
-
硫化钠是一种重要的化工原料。工业上用硫酸钠与碳反应得到硫化钠。反应方程式如下:
Na2SO4 + 2C
Na2S + CO2↑
完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子有 种能级不同的电子。
(2)下列可以证明二氧化碳是非极性分子的事实是 (填编号)
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)硫化钠在一定条件下会与硫单质反应生成多硫化钠(Na2SX)。在碱性溶液中,Na2SX与NaBrO3反应生成Na2SO4与NaBr。若Na2SX与NaBrO3反应的物质的量之比为3:16,则 x = 。
(4)写出硫氢化钠与少量硫酸铜溶液反应的离子方程式 。能否用硫酸铜溶液来鉴别硫化钠溶液和硫氢化钠溶液?请简述实验操作和现象并说明自己的观点: 。
(5)已知:H2S Ki1 = 9.1×10-8 Ki2 = 1.1×10-12 HF Ki = 3.5×10-4
H2SO3 Ki1 = 1.5×10-2 Ki2 = 1.0×10-7 HAc Ki = 1.75×10-5
若用右图的装置,用硫化钠固体和下列溶液制取硫化氢气体,可选用的试剂是 。

a.硝酸 b.亚硫酸氢钠 c.氢氟酸 d.醋酸
高三化学填空题困难题查看答案及解析
-
硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:
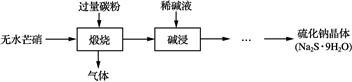
(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
高三化学计算题困难题查看答案及解析
-
硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:
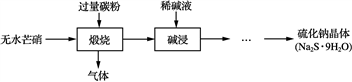
(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
高三化学计算题困难题查看答案及解析
-
硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:
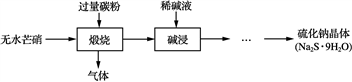
(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
高三化学计算题困难题查看答案及解析
-
硫化钠是重要的化工原料,多釆用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2C
Na2S+2CO2↑。其主要流程如图如下:

(1)上述流程中采用稀碱液比用热水更好,理由是_____________________。
(2)已知I2+2S2O32-═2I-+S4O62-所制Na2S·9H2O晶体中含有Na2SO4·5H2O等杂质为测定产品成分进行下列实验步骤如下:
a.取试样10.00g配成500.00mL溶液
b.取所配溶液25.00mL于碘量瓶中加入过量ZnCO3悬浊液除去Na2S后过滤向滤液中滴入2~3滴淀粉溶液用0.050 00mol·L-1I2溶液滴定至终点用去5.00mL I2溶液
c.再取所配溶液25.00mL于碘量瓶中加入50.00mL 0.050 00mol·L-1I2溶液并滴入2~3滴淀粉溶液振荡用标准Na2SO4溶液滴定多余I2用去15.00mL 0.100 0mol·L-1 Na2SO4溶液
①步骤b中用ZnCO3除去Na2S离子方程式为_________________。
②判断步骤c中滴定终点方法为________________________。
③计算试样中Na2S·9H2O和Na2SO4·5H2O质量分数(写出计算过程)_________________。
高三化学实验题中等难度题查看答案及解析
-
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO•Cr2O3)制备红矾钠的过程中会发生如下反应:4FeO(s)+Cr2O3(s)+8Na2CO3(s)+7O2(g)
8Na2CrO4(s)+
2Fe2O3(s)+8CO2(g) ΔH<0
(1)请写出上述反应的化学平衡常数表达式:K= 。
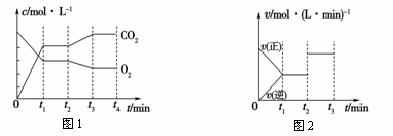
(2)图1、图2表示上述反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线。由图1判断,反应进行至t2时,曲线发生变化的原因是____________________(用文字表达);
由图2判断,t2到t3的曲线变化的原因可能是________(填写序号)。
A.升高温度 B.加了催化剂 C.通入O2 D.缩小容器体积
(3) 工业上可用上述反应中的副产物CO2来生产甲醇:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),已知该反应能自发进行,在容积固定的密闭容器中,由CO2和H2合成甲醇,则下列图像正确的是 。
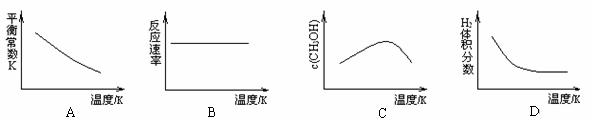
高三化学简答题困难题查看答案及解析
-
硫代硫酸钠(Na2S2O3)是重要的含硫化合物,常用作分析滴定剂。某化学兴趣小组进行了以下有关实验。
实验一: 硫代硫酸钠的制备
硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:
Na2S+Na2CO3+SO2→Na2S2O3+CO2(未配平)
利用如图所示装置可以制取硫代硫酸钠。回答下列问题:

(1) 仪器a的名称为_________。
(2)装置C的作用有________、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是______________。
(3) 为提高Na2S2O3纯度,应使装置D中Na2S和Na2CO3恰好完全反应,则装置D 中Na2S 和Na2CO3物质的量之比为___________。
(4)制得Na2S2O3后,关闭K2和仪器a的活塞,打开K1。装置A 的作用是_______。
(5)待D 中溶液冷却后,经过蒸发浓缩、冷却结晶可获得硫代硫酸钠晶体,所得晶体中可能含有Na2CO3、Na2S、Na2SO4等杂质。用实验证明产品中存在Na2SO4。完成下列表格:
实验
结论
取少量产品于试管中,加适量水溶解,加入足量_____,振荡、静置,取上层清液,滴加____溶液,产生白色沉淀。
产品中存在Na2SO4
实验二: 用硫代硫酸钠溶液测定KI 溶液浓度
①取待测KI 溶液100mL,通入Cl2将I-氧化为IO3-,除去多余Cl2。
②再向溶液中加入足量KI,将IO3-还原为I2。该过程中发生反应的离子方程式为_______。
③用移液管取25.00mL步骤②后的溶液于锥形瓶中,加入几滴______溶液作指示剂,用0.01mol/L的硫代硫酸钠标准溶液滴定(2S2O32-+I2=S4O62-+2I-),至滴定终点共消耗标准液24.00mL,待测KI 溶液的物质的量浓度为______mol/L。若实验中未用硫代硫酸钠标准液润洗滴定管,对测定结果造成的影响是__________。
高三化学实验题困难题查看答案及解析
-
我国芒硝(Na2SO4·10H2O)的储量丰富,它是重要的化工原料。
(1)制备碳酸钠。
①以芒硝和碳酸氢铵为原料,在水溶液中经复分解反应析出NaHCO3晶体,其反应的化学方程式是________。
②已知:ⅰ.2NaOH(s) + CO2(g) == Na2CO3(s) + H2O(g) ΔH1=−127.4 kJ·mol− 1
ⅱ.NaOH(s) + CO2(g) == NaHCO3(s) ΔH2=−131.5 kJ·mol− 1
反应2NaHCO3(s) == Na2CO3(s) + H2O(g) + CO2(g) ΔH= ________ kJ·mol− 1。
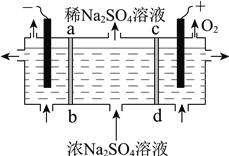
(2)制备烧碱和硫酸。
用右图所示装置,以惰性电极进行电解,ab、cd均为离子交换膜。则阳极区制备的溶液是________,阴极的电极反应式是________。
高三化学综合题困难题查看答案及解析
-
硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)
i.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
ⅱ.Na2S2O3易被氧化,BaSO3难溶于水,可溶于稀盐酸。
(实验一)实验室通过如如图所示装置制备Na2S2O3。

(1)实验中要控制SO2生成速率,可采取的措施有___________(写出一条)。
(2)b装置的作用是______________________。
(3)实验结束后,在e处最好连接盛___________(填“NaOH溶液”、“水”、“CCl4”中的一种)的注射器,接下来的操作为___________,最后拆除装置。
(4)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_________________________________。沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(实验二)测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定时1.000×10-4mol/L的标准AgNO3溶液应用___________(填仪器名称)盛装;滴定终点时的现象是___________。
(6)处理后的废水是否达到排放标准:___________(填“是”或“否”)。
高三化学实验题中等难度题查看答案及解析