-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
 三氯化氮
三氯化氮 是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量
是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是______。氯碱工业生产时,由于食盐水中通常含有少量 ,而在阴极区与生成的氯气反应产生少量
,而在阴极区与生成的氯气反应产生少量 ,该反应的化学方程式为______。
,该反应的化学方程式为______。
 一定条件下,不同物质的量的
一定条件下,不同物质的量的 与不同体积的
与不同体积的 溶液充分反应放出的热量如下表所示:
溶液充分反应放出的热量如下表所示:
该条件 与NaOH 溶液反应生成
与NaOH 溶液反应生成 的热化学反应方程式为______。
的热化学反应方程式为______。
 利用CO可以将NO转化为无害的
利用CO可以将NO转化为无害的 ,其反应为:
,其反应为: ,向容积均为1L的甲,乙两个恒温
,向容积均为1L的甲,乙两个恒温 温度分别为
温度分别为 、
、 容器中分别加入
容器中分别加入 和
和 ,测得各容器中
,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
 甲容器中,
甲容器中, 内用NO的浓度变化表示的反应速率
内用NO的浓度变化表示的反应速率 ______。
______。
 该反应的
该反应的 ______
______ 填“
填“ ”或“
”或“ ”
” 。
。
 甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______
甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______ 填“正向”、“逆向”或“不”
填“正向”、“逆向”或“不” 移动。
移动。
 常温下,在
常温下,在 溶液中,反应
溶液中,反应 的平衡常数
的平衡常数 ______。
______。 已知常温下,
已知常温下, 的电离平衡常数
的电离平衡常数 ,
, 的电离平衡常数
的电离平衡常数 ,
,
 在酸性电解质溶液中,以惰性材料作电极,将
在酸性电解质溶液中,以惰性材料作电极,将 转化为丙烯的原理如图所示
转化为丙烯的原理如图所示
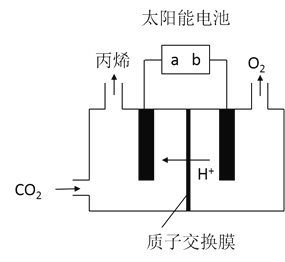
 太阳能电池的负极是______
太阳能电池的负极是______ 填“a”或“b”
填“a”或“b”
 生成丙烯的电极反应式是______。
生成丙烯的电极反应式是______。
-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为_______。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
| 反应 序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量 /kJ |
| 1 | 0.5 | 0.75 | a |
| 2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:_______。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g) N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300 ℃、T ℃、300 ℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(CO)(甲容器)/mol | 2.0 | 1.5 | 1.1 | 0.8 | 0.8 |
| n(CO)(乙容器)/mol | 2.0 | 1.45 | 1.0 | 1.0 | 1.0 |
| n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=________。
②该反应的ΔH________0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为________。
(4)如图是在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理模型。
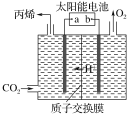
①太阳能电池的负极是________。(填“a”或“b”)
②生成丙烯的电极反应式是_________。
-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g) N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
| n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e-结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学力程式为______________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
| 反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/kJ |
| 1 | 0.5 | 0.75 | a |
| 2 | 1.0 | 2.00 | b |
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g) N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
| n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③丙容器达到平衡时,CO的转化率为____________________________。
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
NH3·2H2O+HC2O4-的平衡常数K=___。(已知常温下,NH3·H2O的电离平衡常数Kb≈2×10-5,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5)
(5)如图是在酸性电解质溶液中,以情性材料作电极,将CO2转化为丙烯的原理模型。
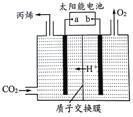
①太阳能电池的负极是_________。(填“a”或“b”)
②生成丙烯的电极反应式是____________________________。
-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
| 反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
| 1 | 0.5 | 0.75 | a |
| 2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g)  N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是__________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为_____________。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0mol/LNaOH溶液充分反应放出的热量如下表所示:
| 反应序号 | n (CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
| 1 | 0.5 | 0.75 | a |
| 2 | 1.0 | 2.00 | b |
该条件CO2与NaOH 溶液反应生成NaHCO3的热化学反应方程式为______________________。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g) +2CO(g)  N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g) +2CO2(g),向容积均为1L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00molNO和2.00molCO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| N甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| N乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________。
②该反应的△H____0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡______(填“正向”、“逆向”或“不”)移动。
(4)常温下, 在(NH4)2C2O4溶液中,反应NH4++C2O42-+H2O NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
NH3·H2O+HC2O4-的平衡常数K=________________________。(已知常温下,NH3·H2O的电离平衡常数Kb=2×10-5,H2C2O4的电离平衡常数Ka1=5×10-2,Ka2=5×10-5)
(5)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如下图所示
①太阳能电池的负极是__________(填“a”或“b”)
②生成丙烯的电极反应式是_____________________________。

-
含碳化合物在生产生活中广泛存在。请回答下列问题:
(1)Andren Dasic等提出在金属催化剂M的作用下以 为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用
为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用 表示),氧原子与
表示),氧原子与 生成
生成 的结合力
的结合力 ,氧原子与乙烯生成乙醛的结合力
,氧原子与乙烯生成乙醛的结合力 ,则可做该反应催化剂的金属M与氧原子的结合力
,则可做该反应催化剂的金属M与氧原子的结合力 (M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。
(M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。
(2)已知 、
、 、
、 的燃烧热分别为
的燃烧热分别为 、
、 、
、 。
。
则反应: ΔH=_________。
ΔH=_________。
(3)已知在含少量的 溶液中,反应
溶液中,反应 分两步进行:第Ⅰ步反应
分两步进行:第Ⅰ步反应 (慢反应),第Ⅱ步为快反应。
(慢反应),第Ⅱ步为快反应。
①请写出第二步反应的化学方程式:____________。
②增大浓度 浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
(4)某密闭容器中发生: ,
, 在不同温度下平衡分解的情况如图2所示。
在不同温度下平衡分解的情况如图2所示。
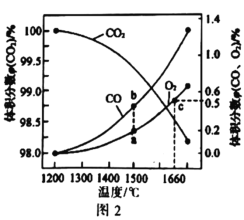
①图中a、b、c三点的平衡常数 的大小关系为_____________。
的大小关系为_____________。
②恒温恒容条件下,能表示该可逆反应达到平衡状态的是____________(填标号)
A. 体积分数与
体积分数与 体积分数的比值保持不变
体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
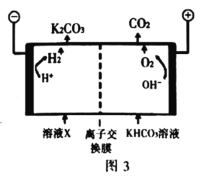
③为实现 减排,目前较成熟的方法是用高浓度的
减排,目前较成熟的方法是用高浓度的 溶液吸收工业烟气中的
溶液吸收工业烟气中的 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置示意图如图3,简述
溶液再生,其装置示意图如图3,简述 在阴极区再生的原理_______。
在阴极区再生的原理_______。
-
NCl3是一种淡黄色油状液体,测定其分子具有三角锥形结构,下列对NCl3的有关描述正确的是 ( )
A.它是一种非极性分子
B.分子中存在非极性共价键
C.NCl3比PCl3难挥发
D.已知NBr3对光很敏感,则NCl3也可能具有光敏性
-
碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)乙炔在Pd表面选择加氢的反应机理如图,其中吸附在Pd表面上的物种用*标注。

上述反应为_____(填“放热”或“吸热”)反应,历程中最小能垒(活化能)为_____kJ/mol,该步骤的化学方程式为_____。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的氮氧化物脱除技术。原理为:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。
5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

A.用催化剂A前50s平均反应速率v(N2)=2.5×10﹣2 mol/(L•s)
B.体系各物质状态不变时,反应在任何温度下均可自发进行
C.分离出体系中的H2O(g)有利于氮氧化物的脱除
D.用催化剂C达到平衡时,N2产率最小
(3)废气的变废为宝越来越成为人们共同关注的焦点,某化学课外小组查阅资料得知:
2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
Ⅰ.2NO(g) N2O2(g) (快) v1正=k1正•c2(NO),v1逆═k1逆•c(N2O2) △H1<0
N2O2(g) (快) v1正=k1正•c2(NO),v1逆═k1逆•c(N2O2) △H1<0
Ⅱ.N2O2(g)+O2(g) 2NO2(g)(慢) v2正=k2正•c(N2O2)•c(O2),v2逆=k2逆•c2(NO2) △H2<0
2NO2(g)(慢) v2正=k2正•c(N2O2)•c(O2),v2逆=k2逆•c2(NO2) △H2<0
请回答下列问题:
①一定温度下,2NO(g)+O2(g) 2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
②研究发现NO转化为NO2的反应速率随温度的升高而减慢,原因是_____。
③已知:N2O4(g) 2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。
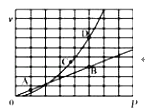
-
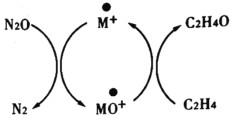
含碳化合物在生产生活中广泛存在,Andren Dasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示,请回答下列问题。
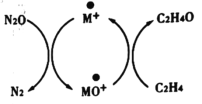
(1)已知N2O(g)+M+(s)=N2(g)+MO+(s) ΔH1=+678kJ·mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ΔH2=-283kJ·mol-1
请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:_________
(2)已知在含少量的I2溶液中,反应CH3CHO (aq) CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
①决定此反应快慢的是第______(填“Ⅰ”或“II”)步反应
②请写出第II步反应的化学方程式:_________
(3)若物质与氧原子的结合力用OA表示,氧原子与N2生成N2O的结合力OA(N2) =167.4 kJ·mol-1, 氧原子与乙烯生成乙醛的结合力OA (C2H4) = 473 kJ·mol-1,则可做该反应催化剂的M+与氧原子的的结合力OA (M+)的值应满足________,使用催化剂会使该反应的活化能________ (填“增大”、 “减小”、“不变”)。
(4)某2L容器中发生: 2CO2(g) 2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
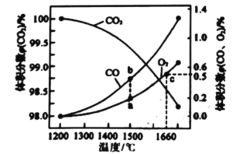
①恒温恒容条件下,能表示该可逆反应达到平衡状态的是______(填标号)
A.CO体积分数与O2体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
②图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为_______
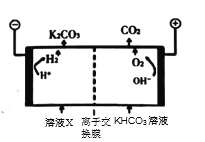
③为实现CO2减排,目前较成熟的方法是用高浓度的K2CO3溶液吸收工业烟气中的CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图,用必要的文字和化学用语简述 在阴极区再生的原理____________。
在阴极区再生的原理____________。

5N2(g)+6H2O(g) △H=﹣11.63 kJ/mol,在2 L密闭容器中,使用不同的催化剂A、B、C,产生N2的物质的量随时间变化如图所示。下列说法正确的_____。

2NO2(g)的反应历程分两步:
N2O2(g) (快) v1正=k1正•c2(NO),v1逆═k1逆•c(N2O2) △H1<0
2NO2(g)(慢) v2正=k2正•c(N2O2)•c(O2),v2逆=k2逆•c2(NO2) △H2<0
2NO2(g)平衡常数K=_____(用k1正、k1逆、k2正、k2逆表示)。
2NO2(g),N2O4与NO2的消耗速率与自身压强有如下关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2•p2(NO2)。一定温度下,相应的速率与压强关系如图所示,图中能表示该反应达到平衡状态的两个点是_____,可以表示该反应正向进行的两个点是_____。











