-
FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
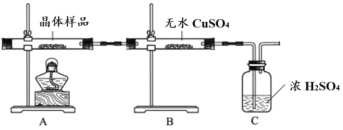
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.6 | 2.7 |
| 完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
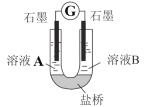
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
| 序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
-
FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
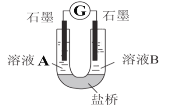
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
-
FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
(资料1)
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________。
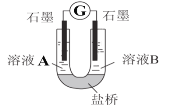
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
(资料2)原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
(资料3)常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对(资料3)实验事实的解释为____________________。
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
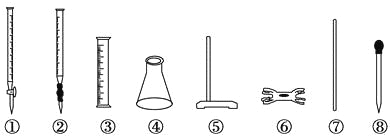
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。

A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]又称莫尔盐,是常用的分析试剂。实验室用FeSO4和(NH4)2SO4两种溶液混合很容易得到莫尔盐晶体。为了确定产品中Fe2+的含量,研究小组用KMnO4(酸化)溶液来滴定莫尔盐溶液中的Fe2+。滴定时必须选用的仪器有 ( )。
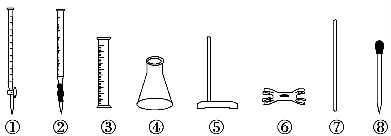
A.①④⑤⑥ B.②③⑦⑧ C.②④⑤⑥ D.④⑤⑥⑧
-
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4·(NH4)2SO4·6H2O。硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。下图是模拟工业制备硫酸亚铁铵晶体的实验装置。回答下列问题:
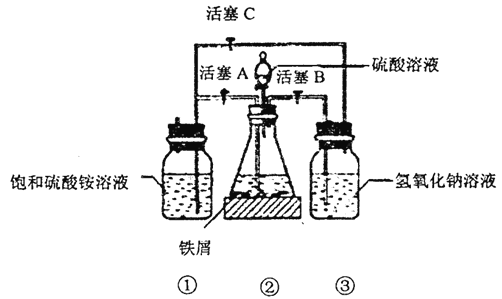
I.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS 等),再用清水洗净。用氢氧化钠溶液煮沸的目的是__________________。
(2)将处理好的铁屑放入锥形瓶中,加入稀硫酸。锥形瓶中发生反应的离子方程式可能为________(填序号)。
A.Fe+2H+==Fe2++H2↑ B.Fe2O3+5H+===2Fe3++3H2O
C.2Fe3++S2-==2Fe2++S↓ D.2Fe3++Fe==3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞_______,打开活塞______(填字母)。容器③中NaOH溶液的作用是___________;向容器①中通入氢气的目的是___________。
I.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。制得的硫酸亚铁铵晶体中往往含有极少量的Fe2+。为测定晶体中Fe2+的含量,称取一份质量为20.0g 的硫酸亚铁铵晶体样品,制成溶液。用0.5 mol/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4- 被还原成Mn2+时,耗KMnO4 溶液体积20.00mL。
滴定时,将KMnO4 溶液装在____(酸式或碱式) 滴定管中,判断反应到达滴定终点的现象为____;晶体中FeSO4的质量分数为____________。
-
(15分)硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐。其化学式为:FeSO4•(NH4)2SO4•6H2O硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了。硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得。三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
如图是模拟工业制备硫酸亚铁铵晶体的实验装置
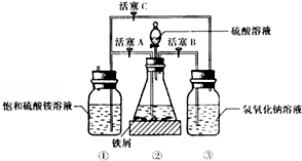
回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净,用氢氧化钠溶液煮沸的目的是 。将处理好的铁屑放入锥形瓶中,加入稀硫酸,锥形瓶中发生反应的离子方程式可能为 (填序号)
A.Fe + 2H+=Fe2+ +H2↑ B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++H2S=2Fe2++S↓+2H+ D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞 ,打开活塞 (填字母)。容器③中NaOH溶液的作用是 ;向容器①中通人氢气的目的是 。
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部。在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是 ;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是 。
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+,为测定晶体中Fe2+的含量,称取一份质量为20.0g的硫酸亚铁铵晶体样品,制成溶液。用0.5mo1/LKMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO‾4被还原成Mn2+时,耗KMnO4溶液体积20.00mL.滴定时,将KMnO4溶液装在 (填酸式或碱式)滴定管中,判断反应到达滴定终点的现象为 ;晶体中FeSO4的质量分数为 。
-
下列事实不能用勒沙特列原理解释的是:
A.氨水应密闭保存,放置低温处
B.在FeSO4溶液中,加入Fe粉以防止变质
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.实验室常用排饱和食盐水的方法收集Cl2
-
硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]俗称摩尔盐.硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定.模拟工业制备硫酸亚铁铵晶体的实验装置如图所示.回答下列问题:
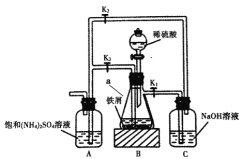
(1)先用饱和碳酸钠溶液煮沸铁屑(含少量油污、铁锈等),再用清水洗净.用饱和碳酸钠溶液煮沸的目的是________________.仪器a的名称是______________.
(2)按如图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中发生反应的离子方程式可能_______________(填字母序号).
A.Fe+2H+=Fe2++H2↑ B.2Fe+6H+=2Fe3++3H2↑
C. Fe2 03+6H+=2Fe3+ +3H2O D. 2Fe3++Fe=3Fe2+
铁屑快反应完时,打开____________,关闭____________,装置B中的溶液会流入装置A,其原因是_____________________.
(3)常温下,将反应后的溶液放置一段时间,瓶底将结晶析出硫酸亚铁铵.为了测定晶体中Fe2+的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液.用0.1mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积为20.00mL.反应到达滴定终点的现象为_________________,计算晶体中Fe2+的质量分数为_________________.









