-
为解决燃料危机和温室效应,科学家尝试用CO2与CH4制取CO和H2。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(1) ΔH2=-128.3kJ·mol-1
CH3OH(1) ΔH2=-128.3kJ·mol-1
③2H2(g)+O2(g) 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
④2CH4(g)+O2(g) 2CH3OH(1) △H4
2CH3OH(1) △H4
在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇在低温下能否自发进行____(填“能”或“否”),理由是____。
(2)某温度下,CH4(g)+H2O(g) CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
(3)CO2用于生产乙烯,已知:2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
一定条件下,按不同的投料比 向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
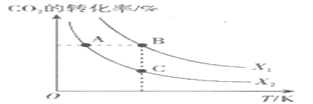
①X1____X2(填“>”或“<”,后同),Q____0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-)∶c(HCO3-)=____。
[常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
②欲用5LNa2CO3溶液将23.3gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为____。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积的变化)
-
为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
T1℃时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
| 时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
| H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
请回答下列问题:
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=__。
(2)30s时CH4的转化率为__,20~40s,v(H2)=__。
(3)T2℃时,该反应的化学平衡常数为1.5,则T2__T1(填“>”“=”或“<”。)
(4)T1℃时反应③达到平衡的标志为__。
A.容器内气体密度不变
B.体系压强恒定
C.CO和H2的体积分数相等且保持不变
D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后,其他条件不变,在70s时再加入2molCH4和1molCO2,此刻平衡的移动方向为__(填“不移动”“正向”或“逆向"),重新达到平衡后,CO2的总转化率比原平衡__(填“大”“小”或“相等”)。
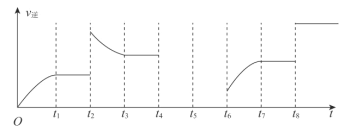
(6)由图可知反应在t1、t2、t3时都达到了平衡,而在t2、t4、t8时都改变了条件,试判断t2时改变的条件可能是__。若t4时降低温度,t5时达到平衡,t6时增大了反应物浓度,请补t4~t6时逆反应速率与时间的关系曲线___。
-
探索CO2与CH4的反应使其转化为CO和H2,对减缓燃料危机,减少温室效应具有重要意义。回答下列问题
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(1) △H2=-128.3kJ·mol-1
CH3OH(1) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为______________________。
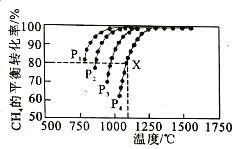
(2)向某密闭恒容容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
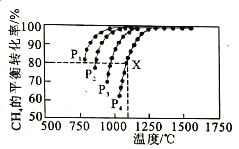
①工业生产时一般会选择在P4和1250℃条件下进行反应,请解释其原因______________________。
②在压强为P4、1100℃的条件下,该反应在5min时达到平衡点X,则0-5min内,用CO表示该反应平均速率为___________;该温度下,反应的平衡常数为___________(保留3位有效数字)。
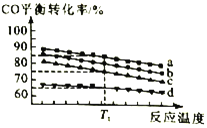
(3)工业上用CO和H2制取甲醇反应方程式为2H2(g)+CO(g) CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
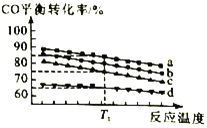
①曲线b对应的投料比是___________
②当反应在曲线a、b、c对应的投料比下达到相同的平衡转化率时,对应的反应温度和投料比的关系是___________。
③投料比为10︰17反应温度为T1时,平衡混合气体中CO的物质的量分数为___________。
-
探索CO2与CH4的反应使其转化为CO和H2,对减缓燃料危机,减少温室效应具有重要意义。回答下列问题
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) CH3OH(1) △H2=-128.3kJ·mol-1
CH3OH(1) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为______________________。
(2)向某密闭恒容容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
①工业生产时一般会选择在P4和1250℃条件下进行反应,请解释其原因______________________。
②在压强为P4、1100℃的条件下,该反应在5min时达到平衡点X,则0-5min内,用CO表示该反应平均速率为___________;该温度下,反应的平衡常数为___________(保留3位有效数字)。
(3)工业上用CO和H2制取甲醇反应方程式为2H2(g)+CO(g) CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
CH3OH(g)。对于该合成反应,若通入的CO的物质的量一定,如图为4种投料比[n(CO)︰n(H2)分别为5︰7、10︰17、5︰9、1︰2]时,反应温度对CO平衡转化率的影响曲线。
①曲线b对应的投料比是___________
②当反应在曲线a、b、c对应的投料比下达到相同的平衡转化率时,对应的反应温度和投料比的关系是___________。
③投料比为10︰17反应温度为T1时,平衡混合气体中CO的物质的量分数为___________。
-
(14分)CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
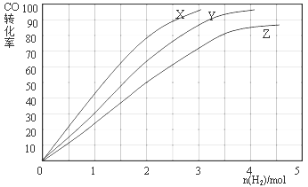
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
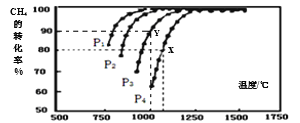
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________。
-
研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g) 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J •mol-1·K-1,该反应能自发进行的温度范围为____________________。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
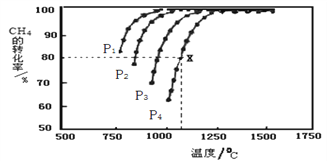
①工业生产时一般会选用P4和1250℃进行合成,请解释其原因_________________________。
②在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_____________________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是____________________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.气体平均相对分子质量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向___________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为_____________________。
-
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
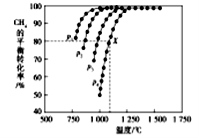
①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
-
(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
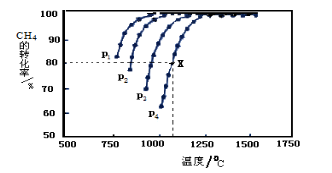
据图可知,P1 、P2、 P3 、P4 由大到小的顺序 。
在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
A.体系压强不再变化 B.H2与CO的物质的量之比为1 :1
C.混合气体的密度保持不变 D. 气体平均相对分子质量为15,且保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。
-
研究CO2与CH4,反应使之转化为CO和H2,对减缓燃料危机、减小温室效应具有重要的意义。
(1)已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-484kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=____________。
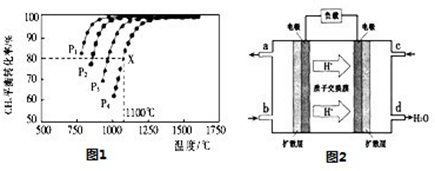
(2)在密闭容器中通人物质的量浓度均为0.1mol/L的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)=2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图1:
①下列事实能说明该反应一定达到平衡的是________。
a.CO2的浓度不再发生变化
b.υ正(CH4)=2υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序为________。
③在压强为P4、1100℃的条件下,该反应5min时达到平衡x点,则用CO表示该反应的速率为________,该温度下,反应的平衡常数为________。
(3)用CO与H2可合成甲醇(CH3OH),以甲醇和氧气反应制成的燃料电池如图2所示,该电池工作程中O2应从________ (填“c或一b”)口通人,电池负极反应式为________,若用该电池电解精炼铜,每得到6. 4g铜,转移电子数目为________。
CO(g)+3H2(g) ΔH1=+206.1kJ·mol-1
CH3OH(1) ΔH2=-128.3kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
2CH3OH(1) △H4
CO(g)+3H2(g),将1molCH4(g)和1molH2O(g)加入100kPa的密闭容器中,正反应速率v正=k正×p(CH4)×p(H2O),逆反应速率v逆=k逆×p(CO)×p3(H2),p为分压(分压=总压×物质的量分数),则该反应的压强平衡常数Kp=____(以k正、k逆表示)。若k正=4.4×104kPa-1·s-1,当CH4分解20%时,v正=____kPa·s-1(保留两位有效数字)。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。
向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。












