-
汽车尾气是产生雾霾的主要因素,对废气的综合治理是当前“打赢蓝天保卫战”的重要举措。
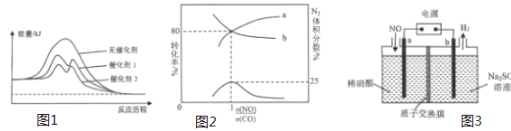
(1)利用某些催化剂,可实现将空气中的碳氧化物和氮氧化物转化为无毒的大气可循环物质。
已知:①N2(g)+O2(g)⇌2NO(g)△H1=+180.5kJ•mol-1
②2C(s)+O2(g)⇌2CO(g)△H2=-221.0kJ•mol-1
③C(s)+O2(g)⇌CO2(g)△H3=-393.5kJ•mol-1
则反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的△H=______kJ•mol-1;某温度下,反应①、②、③的平衡常数分别为K1、K2、K3表示,则该反应的平衡常数K=______(用K1、K2、K3表示)。
(2)在同温同压下,一定量的NO和CO在不同催化剂条件下反应的能量变化如图所示。当反应进行相同的时间时,测得催化剂______(填“1”或“2”)条件下NO转化率更高,其原因是______。

(3)一定温度下,向体积为1L的密闭容器中充入NO和CO的混合气体2mol,在催化剂作用下发生反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g),达到平衡时,NO、CO的转化率及N2的体积分数为 的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。
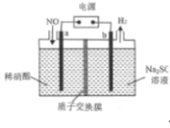
(4)利用如图所示的电解装置能将NO变废为宝,其中a、b为惰性电极。电极a的电极反应式为______。每转移3mol电子,溶液中通过质子交换膜的离子的物质的量是______mol。
-
十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I.汽车尾气中的NO(g)和CO(g)在一定条件下可发生如下反应:
反应①2NO(g)+2CO(g) N2(g)+2CO2(g) △H1
N2(g)+2CO2(g) △H1
(1)已知:反应②N2(g)+O2(g) 2NO(g) △H2=+180.5kJ·mol-1
2NO(g) △H2=+180.5kJ·mol-1
CO的燃烧热为283.0kJ·mol-l,则△H1=___。
(2)在密闭容器中充入5 mol CO和4 mol NO,发生上述反应①,图1为平衡时NO的体积分数与温度、压强的关系。
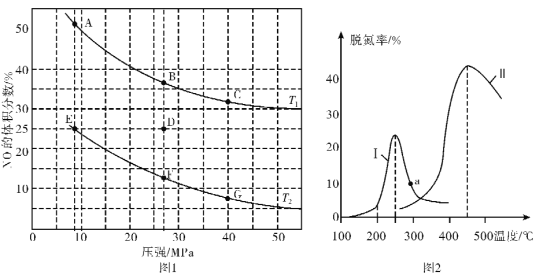
①温度:T1____T2(填“<”或“>”)。
②若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(3)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如上图2所示。若低于200℃,图2中曲线中脱氮率随温度升高而变化不大的主要原因为____;a点 ___(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____。
Ⅱ.N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g) 2I(g)(快反应)
2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。
下列表述正确的是____。
A.N2O分解反应中:k值与是否含碘蒸气无关
B.第二步对总反应速率起决定作用
C.第二步活化能比第三步小
D.IO为反应的中间产物
-
党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO 和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g) +2NO(g)  N2(g) +2CO2(g) △H
N2(g) +2CO2(g) △H
① 已知下列热化学方程式:
N2(g) +O2(g) =2NO(g) △H1 = + 180.5kJ/mol
2C(s) +O2(g) =2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则 △H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2 表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2 各0.4mol,化学平衡将_____移动 (填“向左”“向右”或“不”)。
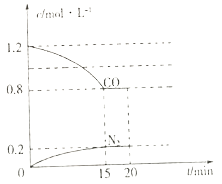
(2)在相同温度下,两个体积均为1L 的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
| 容器编号 | 起始物质的量/mol | 平衡物质的量/mol |
| NO | CO | N2 | CO2 | CO2 |
| I | 0.2 | 0.2 | 0 | 0 | a |
| II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K 为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO 催化转化进行研究。测得NO 转化为N 2的转化率随温度CO 混存量的变化情况如图所示。
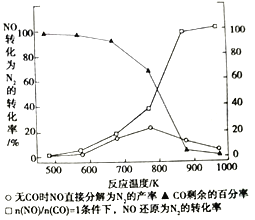
①在n(NO)/n(CO) =1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2 的转化率增大的原因是_______ (用平衡移动的原理解释)。
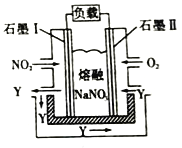
(4)以NO2、O2、熔融NaNO3 组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。
-
工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ. NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,
N2(g)+O2(g)  2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
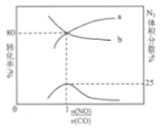
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。
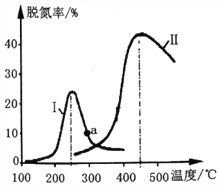
①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2 SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[no(NO2):no(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如右图所示。
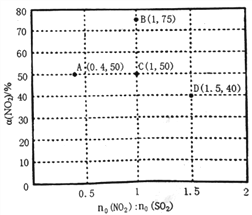
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= ____________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的 =__________。
=__________。
-
工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
Ⅰ.NOx的消除。汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)  N2(g)+2CO2(g) △H。
N2(g)+2CO2(g) △H。
(1)已知:CO燃烧热的△H1=-283.0kJ·mol-l,N2(g)+O2(g)  2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
2NO(g) △H2=+180.5kJ·mol-1,则△H=____________。
(2)某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如下图所示。

①以下说法正确的是__________________(填字母)。
A.两种催化剂均能降低活化能,但△H不变
B.相同条件下,改变压强对脱氮率没有影响
C.曲线Ⅱ中的催化剂适用于450℃左右脱氮
D.曲线Ⅱ中催化剂脱氮率比曲线I中的高
②若低于200℃,图中曲线I脱氮率随温度升高而变化不大的主要原因为___________;判断a点是否为对应温度下的平衡脱氮率,并说明其理由:____________。
Ⅱ.SO2的综合利用
(3)某研究小组对反应NO2+SO2 SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如下图所示。
SO3+NO △H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[α(NO2)]。部分实验结果如下图所示。
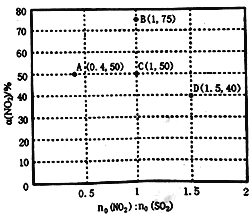
①如果将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是____________。
②图中C、D两点对应的实验温度分别为TC和TD,通过计算判断:TC__________TD(填“>”、“=”或“<”)。
(4)已知25C时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OHˉ)= _________mol·L-1;将SO2通入该氨水中,当溶液呈中性时溶液中的 =__________。
=__________。
-
十九大报告中指出“持续实施大气污染防治行动,打赢蓝天保卫战”。SO2为大气污染物,研究它的性质对治理具有重要意义。在铝基氧化铜作催化剂时,可利用天然气脱除二氧化硫,并回收单质硫(熔点为112.8℃,沸点为444.6℃)。
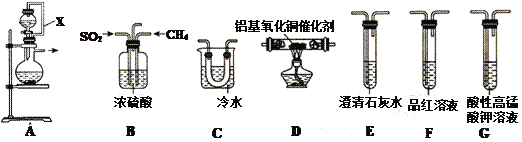
(1)①装置中导管X的作用是:______________________________。
②用装置A制取SO2,则试剂的组合最好是_________(填字母)。
a. 18.4 mol/L H2SO4+Cu b. 4 mol/L HNO3+Na2SO3 c. 60% H2SO4+K2SO3
③水与Al4C3在装置A中制取甲烷,其化学方程式为:________________。
(2)利用制得的CH4和SO2并结合B~G装置验证反应:CH4+2SO2 . 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。
①B装置有三个作用,分别是________________________、充分混合CH4和SO2、观察气泡以便调节CH4和SO2的流速比约为1∶2。
②实验装置依次连接的合理顺序为B、_____________________(每个装置只用一次)。
③证明有CO2产生的现象为_____________________________。
④G装置中发生反应的离子方程式为_____________________________。
-
工业废气、汽车尾气中含有的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中的NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。
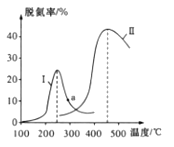
若温度低于200℃,图中曲线脱氯率随温度升高而变化不大的主要原因是___;判断a点对应的脱氮率是否为对应温度下的平衡脱氮率,并说明其理由:____。
-
党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了 PM2.5外,还有 CO、SO2、氮氧化物(NO和 NO2)、O3等气体。
完成下列填空:
(1)S2- 的核外电子排布式为__________, N原子核外电子有______种不同运动状态。
(2)C、O、S、N 四种元素中原子半径最小的是________(写元素符号);写出一个比较O与N非金属性强弱的事实: _____________________________________________。
(3)汽车尾气中含有NO和CO气体,用以下反应除去:2CO(g) +2NO(g)  N2(g) +2CO2 (g) + Q
N2(g) +2CO2 (g) + Q
①该反应的平衡常数表达式为________________________;
②若增大压强,平衡常数__________(填“增大”、 “减小”或“不变”);
③若升高温度,逆反应速率先增大后减小,则 Q ______0(填“>”、 “<”或“=”)。
(4)某温度时,将 0.1mol CO和 0.1mol NO充入2L的密闭容器中,5s后测得生成 0.28g N2,则该时间内v(NO) = _______________。
-
利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g)  N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g)  N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
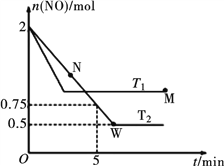
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g)  2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)  LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强
-
利用氢气对废气进行脱碳处理可实现绿色环保、废物利用,对于减少雾霾也具有重要意义。
(1)汽车尾气的主要污染物为NO,用H2催化还原NO可以达到消除污染的目的。
已知:2NO(g)  N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
2H2O(l)===2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
写出H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是______________。
(2)某研究小组模拟研究如下:向2 L恒容密闭容器中充入2 mol NO发生反应2NO(g)  N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
N2(g)+O2(g),在不同的温度下,反应过程中物质的量与时间的关系如图所示:
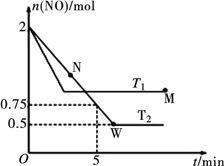
①T2下,在0~5 min内,v(O2)=______________mol·L-1·min-1;该温度下反应N2(g)+O2(g)  2NO(g)的平衡常数K=______________。
2NO(g)的平衡常数K=______________。
②该反应进行到M点放出的热量______________进行到W点放出的热量(填“>”、“<”或“=”)。
M点时再加入一定量NO,平衡后NO的转化率______________(填“变大”、“变小”或“不变”)。
③反应开始至达到平衡的过程中,容器中下列各项发生变化的是______________(填序号)。
a.混合气体的密度 b.逆反应速率
c.单位时间内,N2和NO的消耗量之比 d.气体的平均相对分子质量
(3)氢气作为一种理想燃料,但不利于贮存和运输。利用氢能需要选择合适的储氢材料,镧镍合金在一定条件下可吸收氢气形成氢化物:LaNi5(s)+3H2(g)  LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
LaNi5H6(s) ΔH<0,欲使LaNi5H6(s)释放出气态氢,根据平衡移动原理,可改变的条件是______________(填字母编号)。
A.增加LaNi5H6(s)的量 B.升高温度
C.使用催化剂 D.减小压强


的关系如图所示,表示NO转化率的曲线为______(填“a”或“b”),该反应的平衡常数K=______。








 =__________。
=__________。


 2S+CO2+2H2O生成的单质S和CO2。
2S+CO2+2H2O生成的单质S和CO2。

