-
利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
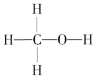
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):

3H2(g)+CO2(g)  CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
| 化学键 | C-H | C-O | C=O | H-H | O-H |
| 键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
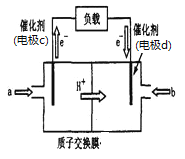
②废气中的CO2转化为甲醇可用于制作甲醇燃料电池(结构如图),质子交换膜左右两侧的溶液均为1L2mol·L-1H2SO4溶液。该燃料电池中通入甲醇的一极为____(填a或b),当电池中有1mol e-发生转移时左右两侧溶液的质量之差为______g (假设反应物耗尽,忽略气体的溶解)。
(2)H2还原法可消除氮氧化物
已知: N2(g)+2O2(g)=2NO2(g) △H=+133kJ·mol-1
H2O(g)= H2O(l) △H=-44kJ·mol-1
H2的燃烧热为285.8kJ·mol-1
①在催化剂存在下,H2还原NO2生成水蒸气和氮气的热化学方程式为_____________。
② 以H2(g)为燃料可以设计氢气燃料电池,该电池以稀NaOH作电解质溶液,其负极电极反应式为___________________________________________________________,已知该电池的能量转换效率为86.4%,则该电池的比能量为________kW·h·kg-1(结果保留1位小数,比能量=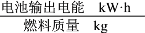 ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。
(3)微生物燃料电池(MFC)是一种现代化的氨氮去除技术。下图为MFC碳氮联合同时去除的示意图。
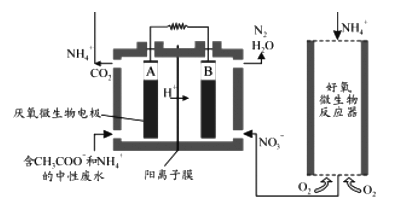
①已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式____________________________________________。
②解释该装置去除NH4+的原理_______________________________________________。
(4)利用“ Na—CO2”电池可将CO2变废为宝。
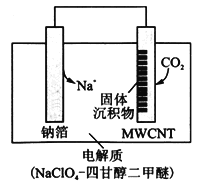
我国科研人员研制出的可充电“ Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料(反应前两电极质量相等),总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为______________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为_________g。
-
利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
3H2(g)+CO2(g)  CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
| 化学键 | C-H | C-O | C=O | H-H | O-H |
| 键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。
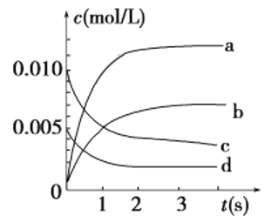
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
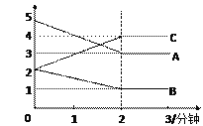
该反应的的化学方程式为________________。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2=-58 kJ/mol
CH3OH(g)+H2O(g) △H2=-58 kJ/mol
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41 kJ/mol
CO(g)+H2O(g) △H3=+41 kJ/mol
回答下列问题:
(1)CO2的电子式是 。
(2)△H1= kJ/mol,①反应正向的熵变△S 0(填>、<或=)。
(3)在容积为2L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图,下列说法正确的是__________(填序号)
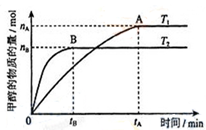
①温度为T1时,从反应到平衡,生成甲醇的平均速率为:v(CH3OH)=nA/tA mol/(L·min)
②当v(CH3OH) = v(H2O)时,说明反应达到平衡
③混合气体的平均相对分子质量A点大于B点
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)与n(CH3OH)比值增大
(4)在T1温度时,将2molCO2和6molH2充入2L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,,则容器内的压强与起始压强之比为__________;T1温度,反应CH3OH(g)+H2O(g) CO2(g)+3H2(g)的平衡常数数值为__________。
CO2(g)+3H2(g)的平衡常数数值为__________。
-
甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g) CH3OH(g) △H1=-99kJ•mol-1
CH3OH(g) △H1=-99kJ•mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:CH3OH结构式
| 化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
| E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=____________。
(2)关于反应①下列说法,正确的是____________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如图所示:
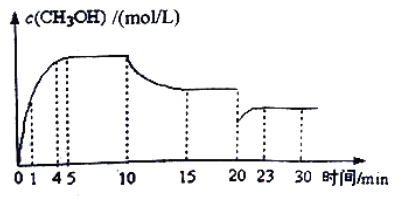
①从反应开始到5min时,生成甲醇的平均速率为____________。
②H2的平衡转化率α=____________%,化学平衡常数K=____________。
③1min时,υ正____________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正____________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小____________。
⑥若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数____________0.1(填“>”、“<”或“=”)。
-
化工发展是我国能源安全的重要保证。近年来,我国煤化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇
Ⅱ.CO2与H2反应合成甲醇 CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应Ⅰ是原子经济性反应,写出化学反应方程式___________。
(2)在工业上,为了提高上述反应Ⅱ的反应速率,除了采用合适的催化剂之外,还可以采取的措施是_______(填一项即可)。
(3)一定温度下,在容积固定的密闭容器中发生反应Ⅱ,下列可以表明反应达到化学平衡状态的是_____。
a.单位时间消耗nmolCO2的同时,消耗3n mol的H2
b.容器内CH3OH的浓度不再改变
c.容器内气体压强不再改变
d.容器内气体密度不再改变
(4)生成1mol CH3OH放出 a kJ的能量,反应Ⅰ中拆开1mol化学键所需的能量(E)的相关数据如下:
| 化学键 | H—H | C—O | CO中的 C O O | H—O | C—H |
| E(kJ) | m | n | E1 | x | y |
根据相关数据计算拆开1molC O所需的能量E1=______________kJ。
O所需的能量E1=______________kJ。
(5) H2还原CO2电化学法制备甲醇的工作原理如下图所示: 
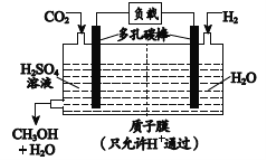
通入H2 的一端是电池的________极(填“正”或“负”),通入CO2的一端发生的电极反应式为_______。
-
能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一。
(1)利用工业废气CO2可制取甲醇,己知常温常压下下列反应的能量关系如图:
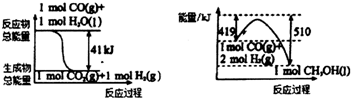
则CO2与H2反应生成液态CH3OH 的热化学方程式为_______________________。
(2)CH4 和H2O(g)通过下列转化也可以制得CH3OH:
I.CH4(g)+H2O(g) CO(g)+3H2(g); △H1>0
CO(g)+3H2(g); △H1>0
II.CO(g)+2H2(g) CH3OH(g); △H2<0
CH3OH(g); △H2<0
将1.0molCH4 和3.0molH2O (g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如下图所示。
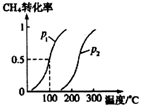
① 图中的P1___P2(填“<”、“>”或“=”) ,判断的理由是________________。
② 若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是______(填序号)。
A.生成CH3OH 的速率与消耗CO 的速率相等 B.混合气体的密度不变
C.混合气体的总物质的量不变 D.CH3OH、CO、H2的浓度都不再发生变化
③在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol· L-1)变化如下表所示:
| 2min | 5min | 10min |
| CO | 0.07 | 0.06 | 0.05 |
| H2 | 0.14 | 0.12 | 0.20 |
| CH3OH | 0.03 | 0.04 | 0.05 |
若5min时只改变了某一条件,则所改变的条件是_______________。
-
近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应:CO(g)+2H2(g) CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
CH3OH(g),体系中甲醇的物质的量n(CH3OH)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CH3OH) (mol) | 0 | 0.009 | 0.012 | 0.013 | 0.013 |
(1)下图中表示CH3OH的浓度变化的曲线是_________(填字母)。
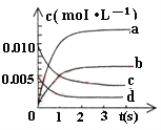
(2)用H2表示从0~2s内该反应的平均速率v(H2) =__________。随着反应的进行,该反应的速率在逐渐减慢的原因是 _____________。
(3)能说明该反应已达到平衡状态的是________。
a.容器内CO与CH3OH的浓度相等 b.v逆(CO) = v正(H2)
c.容器内气体的密度保持不变 d.容器内气体的压强不变
(4)该反应是一个放热反应,说明该反应中破坏1mol CO和2mol H2的化学键吸收的能量_________形成1mol CH3OH释放的能量(填“﹤”、“=”或“﹥”)。
(5)已知在400 ℃时,反应CO(g)+2H2(g) CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
CH3OH(g) 生成1 mol CH3OH(g),放出的热量为116 kJ。计算上述反应达到平衡时放出的热量Q =_________kJ。
-
近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g)  CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
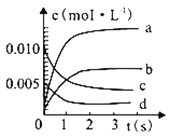
(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a.升高温度 b.加入催化剂 c.增大压强 d.及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变 b.v(H2)=2 v(CO)
c.CO的物质的量分数保持不变 d.容器内气体密度保持不变
e.每生成1molCH3OH的同时有2molH-H键断裂
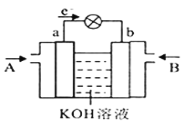
(4)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,图中CH3OH从__________(填A或B)通入,b极的电极反应式是__________。
-
.在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)  CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
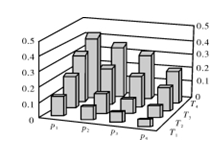
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1> T2> T3>T4,则该反应为放热反应
D.缩小容积,可以提高CH3OH在混合物中的质量分数
-
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)  CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
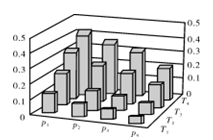
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1> T2> T3>T4,则该反应为放热反应
D.缩小容积,可以提高CH3OH在混合物中的质量分数
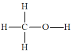 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)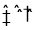 CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。 mol-1)
mol-1)

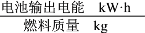 ,1 kW·h=3.6×106 J) 。
,1 kW·h=3.6×106 J) 。














