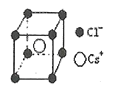-
已知元素N、S、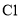 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
(1)Se与S是同族元素,请写出基态Se原子的电子排布式:__。N与S是不同族元素,请解释NH3在水中的溶解度比H2S大的原因:__。
(2)有一种由1~9号元素中的部分元素组成,且与SCl2互为等电子体的共价化合物,它的分子式为__。借助等电子体原理可以分析出SCN-中σ键和π键的个数比为__。
(3)已知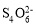 的结构为
的结构为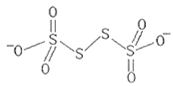 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。
(4)N、P可分别形成多种三角锥形分子,已知NH3的键角大于PH3,原因是__。
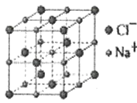
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,见下表:
| 半径比 | 0.225~0.414 | 0.414~0.732 | 0.732~1 |
| 典型化学式 | 立方ZnS | NaCl | CsCl |
| 晶胞 | 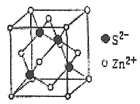
| 
| 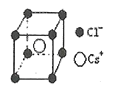
|
已知某离子晶体RA,其阴阳离子半径分别为184pm和74pm,摩尔质量为Mg/mol,则阳离子配位数为__,晶体的密度为__g/cm3(列出计算式,无需化简,设NA为阿伏加德罗常数的值)。
-
前四周期的元素及其化合物在生产、生活、化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式_________________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是_______。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_______________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
(4)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是 ______ (填元素符号)
| 元素 | 氟 | 氯 | 溴 | 碘 |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
②根据价层电子对互斥理论,预测ClO4-的空间构型为_______形,C1O2- 中Cl原子的杂化方式为_________。
③元素C、O、F、H的电负性由大到小的顺序为______________________。
-
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的简化核外电子排布式为__,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
| GeCl4 | GeBr4 | GeI4 |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是___。
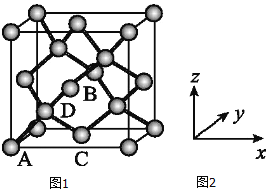
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
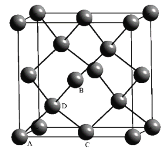

②晶胞参数,描述晶胞的大小和形状。已知单晶Ge的晶胞参数a=565.76pm,其密度为___g·cm-3(列出计算式即可)。
-
锗 是典型的半导体元素,在电子、材料等领域应用广泛
是典型的半导体元素,在电子、材料等领域应用广泛 回答下列问题:
回答下列问题:
(1)基态Ge原子的核外电子排布式为 ______,有______个未成对电子.
______,有______个未成对电子.
(2) 与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键
与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键 从原子结构角度分析,原因是______.
从原子结构角度分析,原因是______.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因______.
(4)光催化还原 制备
制备 反应中,带状纳米
反应中,带状纳米 是该反应的良好催化剂
是该反应的良好催化剂 、Ge、O电负性由大至小的顺序是______
、Ge、O电负性由大至小的顺序是______
(5) 单晶具有金刚石型结构,其中Ge原子的杂化方式为______微粒之间存在的作用力是______.
单晶具有金刚石型结构,其中Ge原子的杂化方式为______微粒之间存在的作用力是______.
(6)晶胞有两个基本要素:  原子坐标参数,表示晶胞内部各原子的相对位置,如图
原子坐标参数,表示晶胞内部各原子的相对位置,如图 、
、 为Ge单晶的晶胞,其中原子坐标参数A为
为Ge单晶的晶胞,其中原子坐标参数A为 ;B为
;B为 ;C为
;C为 则D原子的坐标参数为______.
则D原子的坐标参数为______.
 晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数
晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数 ,其密度为______
,其密度为______  列出计算式即可
列出计算式即可 .
.
-
碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
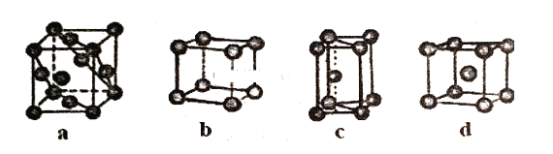
(3)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___ (填字母)。
-
铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
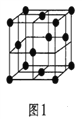
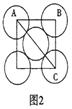
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为a cm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含 a、M、NA的代数式来表示)。
-
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为___________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_____________。
(3)光催化还原CO2 制备CH4反应中,带状纳米Zn2GeO4 是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______。
-
碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22−与O22+互为等电子体,O22+的电子式可表示为________。
-
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]____________,有__________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
| GeCl4 | GeBr4 | GeI4 |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
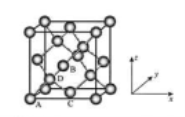
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______________微粒之间存在的作用力是_____________。
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为______。
,0)。则D原子的坐标参数为______。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为__________g·cm-3(列出计算式即可)。
-
金属镍在工业上应用广泛,请回答下列问题。
(1) Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____(用元素符号表示)。
(2) 过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=____。与CO互为等电子体的阴离子是____(只写一种),CO分子内σ键与π键个数之比为____。1mol Ni(CO)n中含σ键为____ mol。
(3) 甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)。甲醛分子内C原子的杂化方式为____,甲醇分子内的O—C—H键角____(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
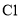 可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题:
可形成多种物质,在工业生产上有着广泛的应用。请回答下列问题: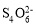 的结构为
的结构为 其中S原子的杂化方式是__。
其中S原子的杂化方式是__。