-
海洋约占地球表面积的71%,是一个远未完全开发的巨大化学资源宝库,海水水资源的利用和海水化学资源的利用具有非常广阔的前景.回答下列问题:
(1)海水淡化处理多用蒸馏法.如图是海水蒸馏原理示意图.蒸馏法的特点是设备结构、操作简单,淡水质量好,但也具有明显的缺陷.
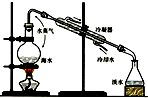
1你认为蒸馏法进行海水淡化的主要缺陷是________;
②我省某沿海地区拟采用蒸馏法兴建一座大型海水淡化工厂,为克服蒸馏法海水淡化的缺陷,请你为该地区提出一条合理化建议________;
(2)海水淡化后得到的淡水应进行技术处理后才能得到完全满足生产、生活要求的水,使用离子交换树脂与水中的离子进行交换是常用的水处理技术.聚丙烯酸钠是一种离子交换树脂,已知丙烯酸钠的化学式为CH2=CH-COONa试写出生成聚丙烯酸钠的化学方程:________;
(3)从海水中可以获取食盐、镁、钾、溴及其化工产品.空气吹出法是目前从海水中提取溴的常用方法,具体流程如下:
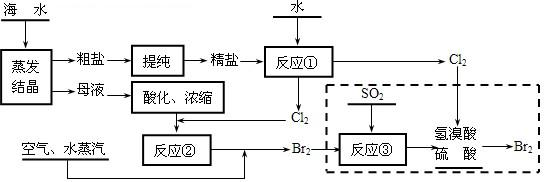
①实验室中粗盐提纯的步骤是________;在反应②中得到的溶液中通入空气、水蒸汽的作用是________;
②反应的离子方程式分别为________;
③在反应中消耗标况下896m3SO2时,共转移________ mol电子;
(4)上述流程中虚线方框内生产流程的作用是________.
-
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
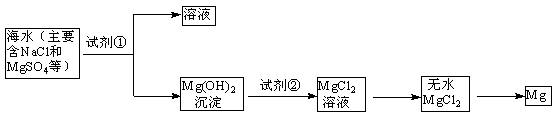
① 试剂①宜选用石灰乳且必须过量,过量的目的是________.
② 镁蒸气宜在________(填序号)气体冷却后得到镁锭(A. N2 B. CO2 C. Ar D. 空气)
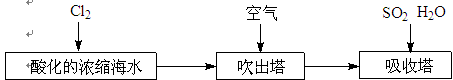
(2)工业以浓缩海水为原料提取溴的部分过程如下:
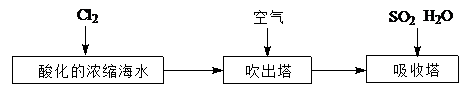
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
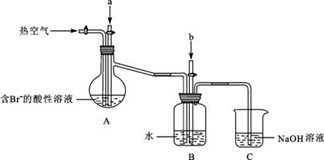
③A装置中通入a气体时,反应的离子方程式表示为:.
④A装置中通入a气体一段时间后,
停止通入,改通热空气。通入热空气的目的是:________.
⑤反应过程中,B装置中产生的两种主要阴离子为.
⑥C装置的作用是________。
-
海洋约占地球表面积的71%,海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下:
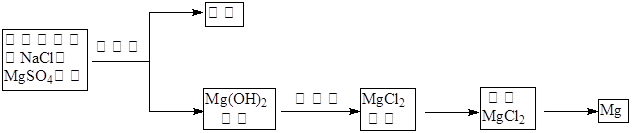 试剂①宜选用石灰乳且必须过量,过量的目的是________.
试剂①宜选用石灰乳且必须过量,过量的目的是________.
② 镁蒸气宜在________(填序号)气体冷却后得到镁锭
A.N2 B.CO2 C.Ar D.空气)(2)工业以浓缩海水为原料提取溴的部分过程如下:
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
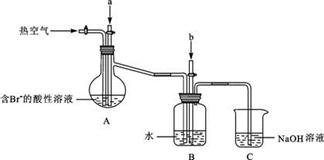
③A装置中通入a气体时,反应的离子方程式表示为:________.
④A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是:________
________.
⑤反应过程中,B装置中产生的两种主要阴离子为________.
⑥C装置的作用是________。
-
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
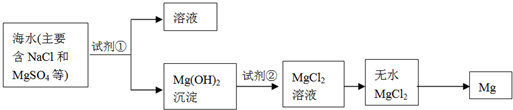
①为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,
②试剂②可以选用________;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是________.
A.Mg(OH)2 MgO
MgO Mg
Mg
B.Mg(OH)2 MgO
MgO Mg
Mg
C.Mg(OH)2
 Mg
Mg
D.Mg(OH)2
 Mg
Mg
④写出电解制备镁的化学方程式________.
-
海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益。通过海水资源的开发利用不能得到的是
A.重水 B.淡水
C.石油、天然气 D.钠、钾、镁、溴
-
海洋约占地球表面积的71%,海水资源的利用具有非常广阔的前景,从海水中可提取多种化工原料。按下图所示工艺流程可利用海水获得Br2:
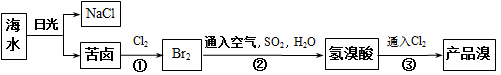
(1)请列举海水淡化的两种方法:________、________
(2)下列不需要化学变化就能够从海水中获得的物质是 。
A.氯、溴、碘 B.食盐、淡水 C.烧碱、氢气 D.钠、镁、铝
(3)步骤 ① 中已获得Br2,步骤②中又将Br2还原为Br-,其目的为_________________。
(4)步骤②用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是______________。
(5)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO的浓度之比为1︰3,则溶液中c(Na+)︰c(ClO-)=___________。
-
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景.
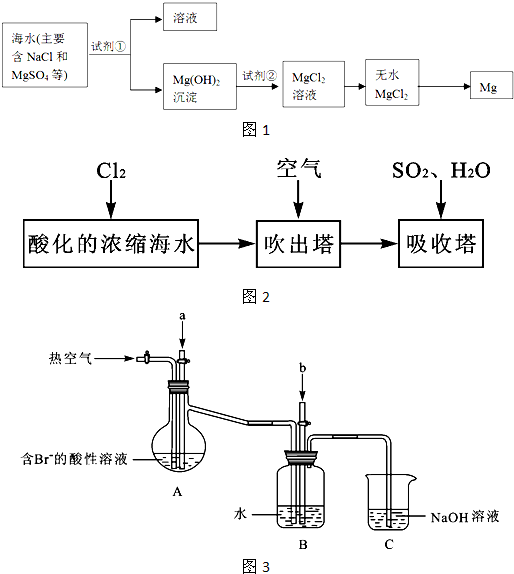
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、______、______可制得精盐.
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如图1所示:
①为了使MgSO4转化为Mg(OH)2,试剂①可以选用______,要使MgSO4完全转化为沉淀,加入试剂①的量应______;
②试剂②可以选用______;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是______.
A.Mg(OH)2 MgO
MgO Mg
Mg
B.Mg(OH)2 MgO
MgO Mg
Mg
C.Mg(OH)2 MgCl2
MgCl2 Mg
Mg
D.Mg(OH)2 MgCl2
MgCl2 Mg
Mg
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作.工业以浓缩海水为原料提取溴的部分过程如图2所示.
某课外小组在实验室模拟上述过程设计如图3所示装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示)______;
②A装置中通入a气体一段时间后,停止通入,改通热空气.通入热空气的目的是______;
③反应过程中,B装置中有SO42-生成.检验SO42-的方法是______;
④C装置的作用是______.
-
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、________、________可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
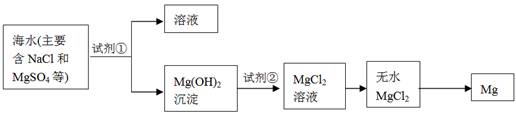
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂①的量应________;
②试剂②可以选用________;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是________。

(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
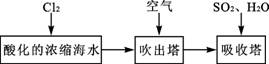
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
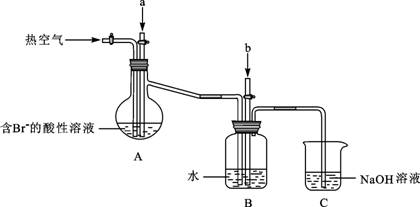
①A装置中通入a气体的目的是(用离子方程式表示);
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是________
________;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是________;
④C装置的作用是。
-
海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、________、________可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
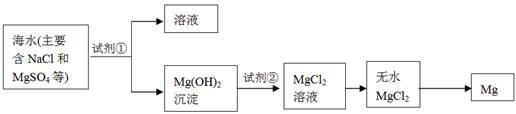
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂①的量应________;
②试剂②可以选用________;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是________。
A. B.
B.
C.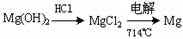 D.
D.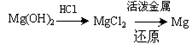
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
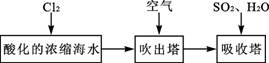
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):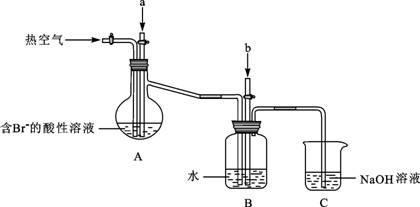
①A装置中通入a气体的目的是(用离子方程式表示)________;
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是________
________;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是;
④C装置的作用是________。
-
海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.下列关于海水资源的说法中,错误的是
A.海带中含有碘元素
B.海水中含有大量氯元素
C.蒸馏法是海水淡化的主要方法之一
D.开发海水资源可以不考虑是否对环境有污染

 ,为除去上述杂质离子,可供选择化学试剂有:
,为除去上述杂质离子,可供选择化学试剂有:




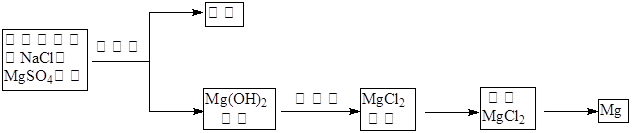 试剂①宜选用石灰乳且必须过量,过量的目的是________.
试剂①宜选用石灰乳且必须过量,过量的目的是________.









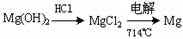 D.
D.

