-
一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式____,其缺点是____(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是____。
(3)基于此,实验进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是____(写1点)。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过下图将H2O2稀溶液浓缩,冷水入口是____(填a或b),增加减压设备的目的是____。
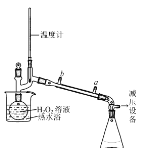
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。从深蓝色溶液中析出深蓝色晶体的简便实验是滴加____________。
III.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为______。
-
一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式________________________________________,此方法硫酸的利用率较低的原因是___________________________(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是___________。
(3)某同学对实验ii进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是_____________________________________。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过如图将H2O2稀溶液浓缩,增加减压设备的目的除了加快蒸馏速度,还有可能是________________________。
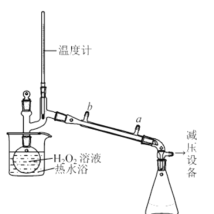
II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式_______________________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。向深蓝色溶液中加入乙醇可析出深蓝色晶体,滴加乙醇的作用可能是________________
A.乙醇可以作还原剂
B.乙醇可以降低该晶体在该溶液中的溶解度
C.乙醇可以作萃取剂
Ⅲ.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为____________。
-
(15分)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
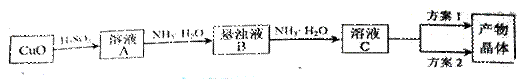
相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
 [Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++ +H2O
+H2O
[Cu(NH3)4]2+ Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:
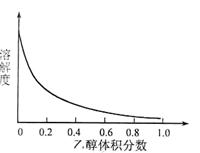
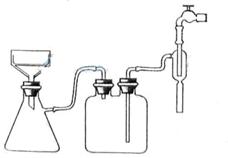
请根据以下信息回答下列问题: 图3
(1)方案1的实验步骤为:
a. 加热蒸发 b. 冷却结晶 c. 抽滤 d. 洗涤 e. 干燥
①步骤1的抽滤装置如图3所示,该装置中的错误之处是________;抽滤完毕或中途停止抽滤时,应先________,然后________。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有________杂质,产生该杂质的原因是________。
(2)方案2的实验步骤为:
a. 向溶液C中加入适量________,b.________,c. 洗涤,d. 干燥
①请在上述内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是________。
-
一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4•H2O是一种重要的染料及农药中间体.某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下以下电离(解离)过程:
[Cu(NH3)4]SO4•H2O=[Cu(NH3)4]2++SO42-+H2O
[Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶.
③[Cu(NH3)4]SO4•H2O在乙醇•水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下: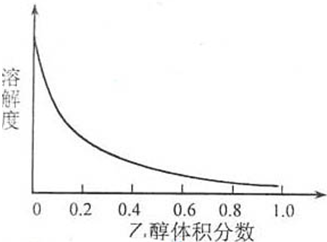
请根据以下信息回答下列问题:
(1)方案1的实验步骤为:
a.加热蒸发 b.冷却结晶 c.抽滤 d.洗涤 e.干燥
①步骤1的抽滤装置如下图所示,该装置中的错误之处是______;抽滤完毕或中途停止抽滤时,应先______,然后______.
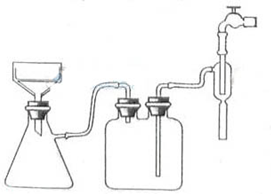
②该方案存在明显缺陷,因为得到的产物晶体中往往含有______杂质,产生该杂质的原因是______.
(2)方案2的实验步骤为:
a.向溶液C加入适量______b.______c.洗涤,d.干燥
①请在上述内填写合适的试剂或操作名称.
②下列选项中,最适合作为步骤c的洗涤液是______.
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是______.
-
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。请回答下列相关问题:
(1)Cu的核外电子排布式为 。
(2)N的L层中有 对成对电子;N 立体构型是 ,其中心原子的杂化方式为 。
立体构型是 ,其中心原子的杂化方式为 。
(3)氨水溶液中存在多种氢键,任表示出其中两种 ;
(4)[Cu(NH3)4]SO4·H2O中呈深蓝色的离子是 ,该微粒中的“电子对给予一接受键”属于 键;
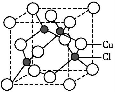
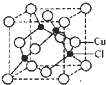
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式 。
-
[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解,摩尔质量为246 g·mol-1。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
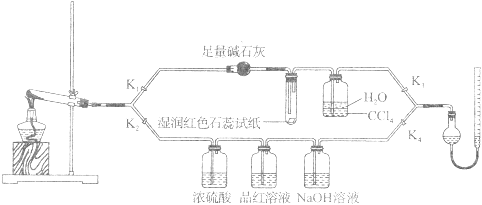
(1)连接装置,_________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式____________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有________________(填化学式)。
(4)CCl4的作用是_________________________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为_____________。
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③_____________。若某同学按右图所示读数,则计算出的分解率__________(填“偏高”“偏低”或“无影响”)。
-
[Cu(NH3)4]SO4·H2O是一种重要的染料及合成农药中间体,受热可分解,摩尔质量为246 g·mol-1。某化学课外小组设计了如下实验(部分夹持装置略)验证它的部分分解产物,请回答问题:
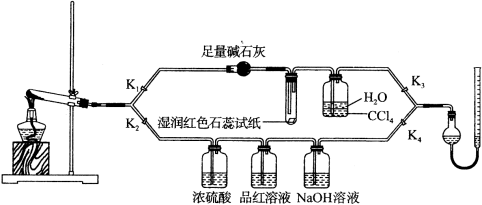
(1)连接装置,_________________________,在各装置中加入相应的药品和试剂。
(2)打开K2、K4,闭合K1、K3,加热一段时间后观察到品红溶液褪色,写出NaOH溶液中发生反应的离子方程式__________________________________________________。
(3)打开K1、K3,闭合K2、K4,继续加热一段时间后观察到湿润红色石蕊试纸变蓝,证明分解产物中含有______________________________(填化学式)。
(4)CCl4的作用是__________________________________________________。
(5)加热过程中,还生成Cu、N2和H2O。写出[Cu(NH3)4]SO4·H2O分解的化学方程式________________________________________。
(6)若实验中称取a g [Cu(NH3)4]SO4 · H2O,收集到b mL N2(已换算成标准状况),[Cu(NH3)4]SO4·H2O的分解率表达式为__________。
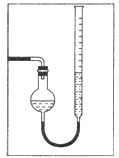
(7)量气管读数时需注意的事项有:①气体冷却到室温;②量气装置两侧液面相平;③___________________________。若某同学按右图所示读数,则计算出的分解率__________(填“偏高”“偏低”或“无影响”)。
-
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4•H2O]是一种重要的染料及农药中间体.请回答下列相关问题:
(1)Cu的核外电子排布式为______.
(2)N的L层中有______对成对电子; 立体构型是______,其中心原子的杂化方式为______.
立体构型是______,其中心原子的杂化方式为______.
(3)氨水溶液中存在多种氢键,任表示出其中两种______;
(4)[Cu(NH3)4]SO4•H2O中呈深蓝色的离子是______,该微粒中的“电子对给予一接受键”属于______键(填“σ”或“π”);
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是______.
-
一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O]常用作杀虫剂,媒染剂,在碱性镀铜中也常用作电镀液的主要成分,在工业上用途广泛。常温下该物质可溶于水,难溶于乙醇,在空气中不稳定,受热时易发生分解。某化学兴趣小组以Cu粉、3mol·L-1的硫酸、浓氨水、10% NaOH溶液、95%的乙醇溶液、0.500 mol·L-1稀盐酸、0.500 mol·L-1 的NaOH溶液来制备一水硫酸四氨合铜晶体并测定其纯度。
I.CuSO4溶液的制取
①实验室用铜与浓硫酸制备硫酸铜溶液时,往往会产生有污染的SO2气体,随着硫酸浓度变小,反应会停止,使得硫酸利用率比较低。
②实际生产中往往将铜片在空气中加热,使其氧化生成CuO,再溶解在稀硫酸中即可得到硫酸铜溶液;这一过程缺点是铜片表面加热易被氧化,而包裹在里面的铜得不到氧化。
③所以工业上进行了改进,可以在浸入硫酸中的铜片表面不断通 O2,并加热;也可以在硫酸和铜的混合容器中滴加 H2O2 溶液。
④趁热过滤得蓝色溶液。
(1)某同学在上述实验制备硫酸铜溶液时铜有剩余,该同学将制得的CuSO4溶液倒入另一蒸发皿中加热浓缩至有晶膜出现,冷却析出的晶体中含有白色粉末,试解释其原因________________。
(2)若按③进行制备,请写出Cu在H2O2 作用下和稀硫酸反应的化学方程式_______________。
(3)H2O2溶液的浓度对铜片的溶解速率有影响。现通过下图将少量30%的H2O2溶液浓缩至40%,在B处应增加一个设备,该设备的作用是____________馏出物是 ______________________。
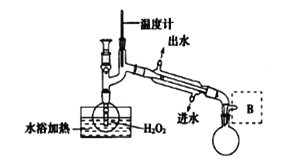
II.晶体的制备
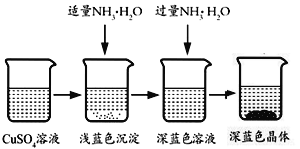
将上述制备的CuSO4溶液按如图所示进行操作
(1)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为 Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式__________。
(2)继续滴加 NH3·H2O,会转化生成深蓝色溶液,请写出从深蓝色溶液中析出深蓝色晶体的方法____________。并说明理由____________。
Ⅲ.产品纯度的测定
精确称取 mg 晶体,加适量水溶解,注入图示的三颈瓶中,然后逐滴加入足量 NaOH 溶液, 通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用 V1mL 0.500mol·L-1 的盐酸标准溶液完全吸收。取下接收瓶,用 0.500 mol·L-1 NaOH 标准溶液滴定过剩的 HCl(选用 甲基橙作指示剂),到终点时消耗 V2mLNaOH 溶液。
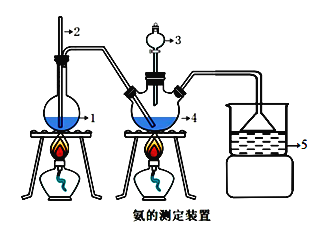
1.水 2.长玻璃管 3.10%NaOH溶液 4.样品液 5.盐酸标准溶液
(1)玻璃管2的作用________________。
(2)样品中产品纯度的表达式________________。(不用化简)
(3)下列实验操作可能使氨含量测定结果偏低的原因是_________________
A.滴定时未用 NaOH 标准溶液润洗滴定管
B.滴定过程中选用酚酞作指示剂
C.读数时,滴定前平视,滴定后俯视
D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁
E.由于操作不规范,滴定前无气泡,滴定后滴定管中产生气泡
-
[化学一选修3:物质结构与性质](15分)
一水硫酸四氨合铜(II)(化学式为 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
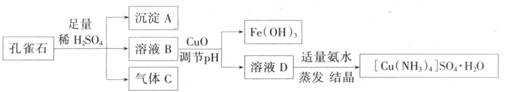
请回答:
(1) 沉淀A的晶体中最小环上的原子个数为______,气体C分子中 键和
键和 键的个数比为______
键的个数比为______
(2) 溶液D的溶质阴离子的空间构型为______,其中心原子的杂化轨道类型为______
(3) MgO的熔点高于CuO的原因为____________
(4) 画出一水硫酸四氨合铜(II)中配离子 的配位键____________。
的配位键____________。
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示, 其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示。
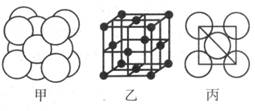
①铜单质晶体中原子的堆积方式为____________,晶胞中Cu原子的配位数为______
②若Cu原子半径为acm,则Cu单质晶体的密度为______g/cm3(只列出计算式,阿伏加德罗常数的值为NA)。


















