-
某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取 Na2Cr2O7 溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
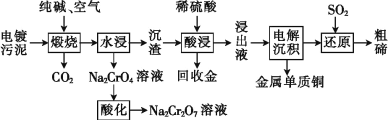
已知:煅烧时,Cu2Te 发生的反应为Cu2Te+2O2  2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时,Cr2O3 发生反应的化学方程式为______。
(2)浸出液中除了含有 TeOSO4(在电解过程中不反应)外,还可能含有_____(填化学式)。
(3)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
通过冷却结晶能析出大量 K2Cr2O7 的原因是_____。
(4)测定产品中 K2Cr2O7 含量的方法如下:称取产品试样 2.50 g 配成 250 mL 溶液,用移液管取出 25.00 mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用 0.1000 mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2 标准液进行滴定,重复进行二次实验。(已知 Cr2 O72-被还原为 Cr3+)
①氧化还原滴定过程中的离子方程式为_____。
②若三次实验消耗(NH4)2Fe(SO4)2 标准液的平均体积为 25.00 mL,则所得产品中 K2Cr2O7 的纯度为_____%。[已知 M(K2Cr2O7)=294 g·mol-1,计算结果保留三位有效数字]。
(5)上述流程中 K2Cr2O7 发生氧化还原反应后所得溶液中除含有 Cr3+外,还含有一定浓度的 Fe3+杂质,可通过加碱调 pH 的方法使两者转化为沉淀。已知 c(Cr3+)=3×10-5 mol·L-1,则当溶液中开始析出 Cr(OH)3 沉淀时Fe3+是否沉淀完全______(填“是”或“否”),写出计算过程________________(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
-
某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可以用于制取Na2Cr2O7溶液、金属铜、粗碲等,以实现有害废料的资源化利用,工艺流程如下:
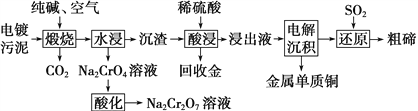
已知:煅烧时Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)煅烧时Cr2O3发生反应的化学方程式为______________。
(2)为提高酸浸速率,可采用的措施是____________(答出两条)。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________(填化学式)。电解沉积过程中析出单质铜的电极为_______极。
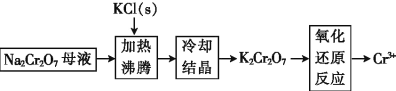
(4)工业上用铬酸钠(Na2Cr2O7)母液生产各酸钾(K2Cr2O7)工艺流程如下图所示:

通过冷却结晶能析出大量K2Cr2O7的原因是____________。
(5)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.50g配成250mL溶液,用移液管取出25.00mL于锥形瓶中,加入足量稀硫酸酸化后,再加入几滴指示剂,用0.1000mol·L-1硫酸亚铁铵(NH4)2Fe(SO4)2标准液进行滴定,重复进行二次实验。(已知Cr2O72-被还原为Cr3+)
①氧化还原滴定过程中的离子方程式为_____________。
②若三次实验消耗(NH4)2Fe(SO4)2标准液的平均体积为25.00mL,则所得产品中K2Cr2O7的纯度为_______﹪(已知M(K2Cr2O7)=294,计算结果保留三位有效数字)。
(6)上述流程中K2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)为3×10-5 mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时Fe3+是否沉淀完全_________(填“是”或“否”)。[已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31]。
-
某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如下:
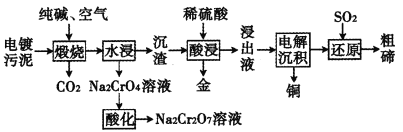
已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)Te元素在元素周期表中的位置为______________其基态原子的电子占据的最高能层符号为________。
(2)煅烧时,Cr2O3发生反应的化学方程式为__________________。
(3)浸出液中除了含有TeOSO4(在电解过程中不反应)外,还可能含有________(填化学式)。电解沉积过程中析出单质铜的电极为_________极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
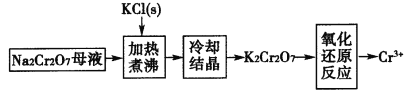
通过冷却结晶能析出大量K2Cr2O7的原因是______________。
(5)测定产品中K2Cr2O7含量的方法如下:称取试样2.50 g配成250 mL溶液,取25.00 mL于锥形瓶中,加入足量稀硫酸和几滴指示剂,用0.1000 mol·L-1(NH4)2Fe(SO4)2标准液进行滴定。滴定过程中发生反应的离子方程式为____________________。
若三次实验消耗(NH4)2Fe(SO4)2标准液的体积平均为25.00 mL,则所得产品中K2Cr2O7的纯度为________%(保留三位有效数字)。
-
电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
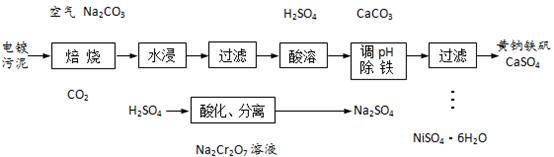
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为_______________。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:_________________。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。
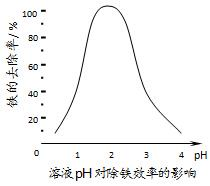
则除铁时应控制溶液的pH为____________(填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___________。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是____________。
(4)从滤液中获取NiSO4·6H2O晶体的操作为________、冷却结晶、过滤、_________、干燥。
-
某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
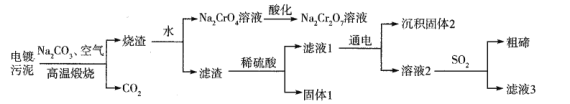
已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
A. “高温”灼烧电镀污泥时铜碲和铬元素都被氧化
B. 酸化Na2CrO4溶液时可用浓盐酸
C. 上述流程可以回收的金属单质有金和铜
D. 滤液3可以循环利用
-
某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
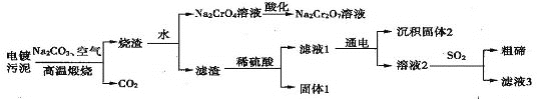
已知:碲和硫位于同主族,煅烧时Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4====TeOSO4+H2O。
2CuO+TeO2,滤渣中TeO2溶于稀硫酸发生的反应为TeO2+H2SO4====TeOSO4+H2O。
下列说法错误的是
A.“高温煅烧”电镀污泥时铜、碲和铬元素都被氧化
B.“酸化”时可向溶液中加入硫酸
C.“固体1”的主要成分为Cu
D.“滤液3”可以循环利用
-
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。
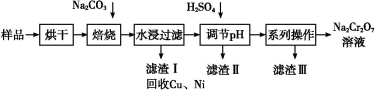
已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+  Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式 。
-
电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。

已知:水浸后溶液中存在Na2CrO4、NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈____性(“酸”、“碱”、“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式:
____Cr(OH)3+____Na2CO3+_____  = ____Na2CrO4+___CO2+_____
= ____Na2CrO4+___CO2+_____
(3)滤渣II的主要成分有Zn(OH)2、___________________________________。
(4)“系列操作”中为:继续加入H2SO4,________冷却结晶,过滤。继续加入H2SO4目的是________________________。
已知:①除去滤渣II后,溶液中存在如下反应:2CrO42ˉ+2H+ Cr2O72ˉ+H2O
Cr2O72ˉ+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
| 温度 化学式 | 20℃ | 60℃ | 100℃ |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
| Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨做电极电解生产金属铬,写出生成铬的电极反应方程式____________________________。
-
重铬酸钠(Na2Cr2O7·2H2O)是重要的化工原料,在化学工业和制药工业中常用作氧化剂。可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下流程来制取重铬酸钠。

回答下列问题:
(1)写出Cr元素基态原子的外围电子排布式____。
(2)步骤I中反应的化学方程式为:4FeO·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g),反应中被氧化的元素是 ,生成2 mol Fe2O3时转移电子的物质的量为 mol。
(3)步骤II中加入NaOH溶液时发生的化学反应方程式为 。
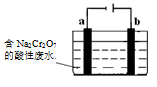
(4)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌。工业上常用电解法来处理含Cr2O72-的废水,电解装置模拟示意图如右图(电极材料为铁和石墨)。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。a电极的电极材料是____,b电极附近生成Cr3+的反应的离子方程式是____。
将含Cr2O3为50%的铬铁矿30.4 kg,按上述流程制取产品Na2Cr2O7·2H2O,假设整个流程中铬元素的利用率为80%,则最终能制得Na2Cr2O7·2H2O kg。
-
电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:
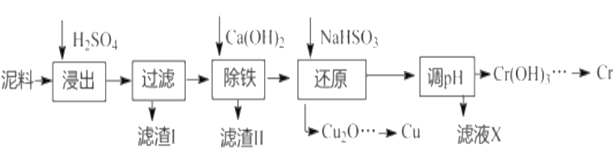
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀的pH | 2.1 | 4.7 | 4.3 |
| 恰好完全沉淀的pH | 3.2 | 6.7 | a |
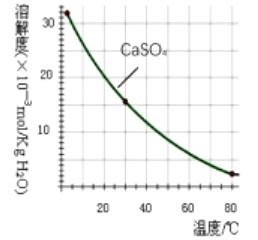
(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31, ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。

2CuO+TeO2。














