-
钛被称为继铁、铝之后的第三金属,请回答下列问题:
(1)金红石(TiO2)是钛的主要矿物之一,基态Ti原子价层电子的排布图为_________,基态O原子电子占据最高能级的电子云轮廓图为 __________形。
(2)以TiO2为原料可制得TiCl4,TiCl4的熔、沸点分别为205K、409K,均高于结构与其相似的CCl4,主要原因是 __________________。
(3)TiCl4可溶于浓盐酸得H2[TiCl6],向溶液中加入NH4Cl浓溶液可析出黄色的(NH4)2[TiCl6]晶体。该晶体中微观粒子之间的作用力有 ________。
A.离子键 B.共价键 C.分子间作用力 D.氢键 E.范德华力
(4)TiCl4可与CH3CH2OH、HCHO、CH3OCH3等有机小分子形成加合物。上述三种小分子中C原子的VSEPR模型不同于其他分子的是 _____,该分子中C的轨道杂化类型为________ 。
(5)TiO2与BaCO3一起熔融可制得钛酸钡。
①BaCO3中阴离子的立体构型为 ________。
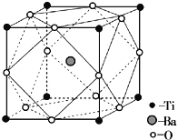
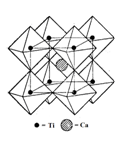
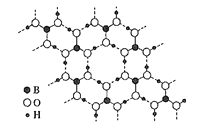
②经X射线分析鉴定,钛酸钡的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),则钛酸钡的化学式为 _________。已知晶胞边长为a pm,O2-的半径为b pm,则Ti4+、Ba2+的半径分别为____________pm、___________pm。
-
钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
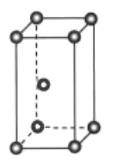
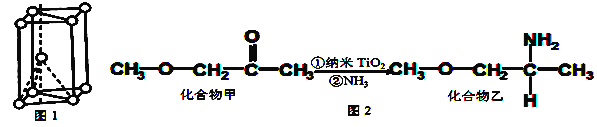
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
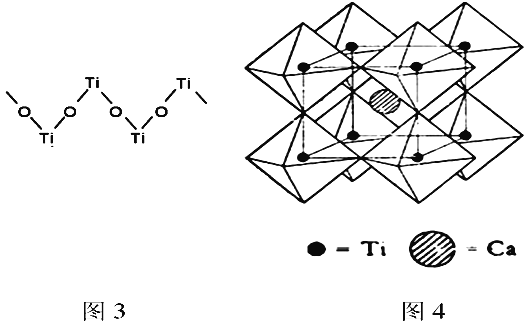
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
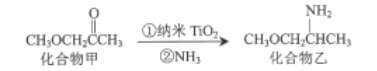
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl3•6H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______g•cm-3.(列出计算式即可)

-
【化学—选修3:物质结构与性质】
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为 ,其原子核外共有 种运动状态不相同的电子。金属钛晶胞如下图1所示,为 堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
| A.180° | B.接近120°,但小于120° |
| C.接近120°,但大于120° | D.接近109°28’,但小于109°28’ |
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为________晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图2。化合物乙的沸点明显高于化合物甲,主要原因是 。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为 。
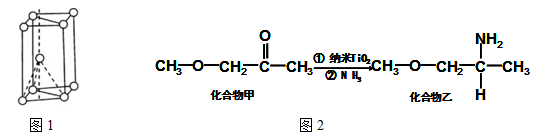
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被 个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被 个氧离子包围。钙钛矿晶体的化学式为 。若该晶胞的边长为a pm,则钙钛矿晶体的密度为 g.cm-3(只要求列算式,不必计算出数值)。
-
金、银、铝、镁、钛,均是人类大量生产和使用的金属。试回答下列问题:
(1)一个原子有多级电离能,从电子排布特点判断第三电离能大小:Mg______Al(填大于或等于或小于)。
(2)钛被称为继铁、铝之后的第三金属。第四周期元素中,未成对电子数目与基态钛原子未成对电子数目相同元素还有__________种。
(3)基态金原子的外围电子排布式为5d106s1,试判断金在元素周期表中的位置_______。
(4)Ag+与氨水形成的二氨合银离子空间构型是直线形,其中配位原子的杂化类型是______。
(5)四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,能与水蒸气反应发烟,生成二氧化钛固体,可以做烟幕剂。四氯化钛中存在的化学键类型是_______,写出上述反应的化学方程式____________________。
(6)工业用电解氯化镁制得镁,而不用氧化镁的原因___________________________。
(7)金单质的晶胞是面心立方结构,已知金相对原子质量为M,晶胞边长为d cm,则一个该晶胞占有的原子总质量为________克。
-
《日华子本草》中已有关于雄黄的记载“雄黄,通赤亮者为上,验之可以虫死者为真。”雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。 回答下列问题:
(1)基态砷原子的价电子轨道排布图为_______,核外电子占据的最高能级的电子云轮廓图形状为_______。
(2) S、P和N三种元素第一电离能由大到小的顺序是_______。
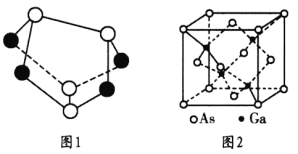
(3) 雄黄(As4S4)的结构如图1所示,S原子的杂化形式为_______。
(4) SO2分子中的 键数为______个,分子的空间构型为_______。分子中的大
键数为______个,分子的空间构型为_______。分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则SO2中的大
),则SO2中的大 键应表示为______。SO2分子中S—O键的键角_____NO3-中N—O键的键角(填“> ”、“<”、“=”)。
键应表示为______。SO2分子中S—O键的键角_____NO3-中N—O键的键角(填“> ”、“<”、“=”)。
(5)砷化镓是优良的半导体材料,密度为  g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则砷化镓晶体的空间利用率为________。
g • cm-3,其晶胞结构如图2所示。Ga和As 原子半径分别为r1 pm和r2 pm,阿伏加德罗常数值为NA,则砷化镓晶体的空间利用率为________。
-
(共8分)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。
试回答下列问题:
(1)Ti元素的基态原子的价电子层排布图为 ;
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
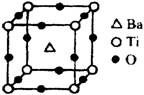
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如图,它的化学式是________;晶体内与每个“Ti”紧邻的氧原子数为________个。
②已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为
-
钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:
(1)基态钛原子的价电子排布图为 ______________,其原子核外共有_______种运动状态不相同的电子, 金属钛晶胞如图1所示,为________ 堆积(填堆积方式)。
(2)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,据此可知TiCl4形成的晶体类型为________。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2,化合物乙的沸点明显高于化合物甲,主要原因是______________,化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为______________。
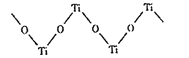
(4)硫酸氧钛晶体中阳离子为链状聚合形状的离子,结构如图3所示,该阳离子Ti与O的原子数之比为___________________,其化学式为_________________。
(5)钙钛矿晶体的结构如图4所示,钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被_________个氧离子包围, 钙钛矿晶体的化学式为______________。
 。
。
-
钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疗等领域都有着重要的应用。请回答下列问题:
(1)在元素周期表中,锆元素与钛元素同族,则锆元素位于__区。
(2)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形成存在的钛酰阳离子,其结构如图所示,若阳离子所带电荷为+n,则该离子中钛原子数为__。
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个Al原子与__个N原子相连,与同一个N原子相连的Al原子构成的立体构型为___,氮化铝晶体属于___晶体。
(4)Ti3+可形成配位数为6的两种配合物晶体(一种是紫色,一种是绿色),组成皆为TiCl3•6H2O。向含有0.01mol绿色配合物晶体的水溶液中加入过量硝酸银溶液,产生0.02molAgCl沉淀,则绿色配合物晶体的化学式为__。
(5)硼与铝同族,硼酸晶体是片层结构,其中一层的结构如图所示,层内的分子以氢键相连。含1mol硼酸的晶体中有__mol氢键。图中所示最外层已达8原子结构的原子是__(填元素符号),H3BO3晶体中B原子个数与极性键个数比为__。
-
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:TiO2→TiCl4 ,已知:①C(s)+O2(g)=CO2(g) △H1
,已知:①C(s)+O2(g)=CO2(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为
A. △H3+2△H1+2△H2 B. △H3+2△H1+△H2
C. △H3+2△H1-△H2 D. △H3+2△H1-2△H2
-
钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤为:TiO2→TiCl4 ,已知:①C(s)+O2(g)=CO2(g) △H1
,已知:①C(s)+O2(g)=CO2(g) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H3
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H为
A. △H3+2△H1+2△H2 B. △H3+2△H1+△H2
C. △H3+2△H1-△H2 D. △H3+2△H1-2△H2











 。
。
