-
用二氧化碳生产化工产品,有利于二氧化碳的大量回收。二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
CO2+

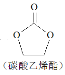 +H2O
+H2O
(1)锌基态原子核外电子排布式为_________;写出一种与CO2互为等电子体的分子的化学式:__________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,提供空轨道的是_____(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为______;1mol碳酸乙烯酯中含有的 键数目为______。
键数目为______。
(4)生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________;
②甲醛分子的空间构型是______________(用文字描述);
(5)抗坏血酸的分子结构如图 1 所示,推测抗坏血酸在水中的溶解性:______(填“难溶于水”或“易溶于水”) ;一个Cu2O 晶胞(见图 2)中,Cu 原子的数目为______ 。
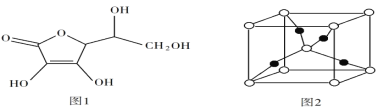
-
碳及其化合物在有机合成、能源开发等方面具有十分广泛的应用。
Ⅰ.工业生产精细化工产品乙二醛(OHC—CHO)
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,此反应的化学方程式为_____________,该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点: ___________________。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484 kJ/mol,化学平衡常数为K1。
OHC—CHO(g)+2H2(g) ⇌HOCH2CH2OH(g) ΔH=-78 kJ/mol,化学平衡常数为K2。
则乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g) ⇌OHC—CHO(g)+2H2O(g)的ΔH=______。相同温度下,该反应的化学平衡常数K=_______(用含K1、K2的代数式表示)。
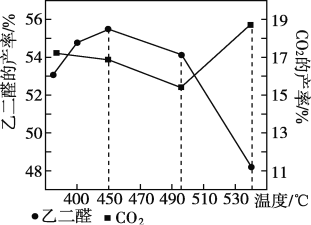
②当原料气中氧醇比为4∶3时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495 ℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____________、___________。
Ⅱ.副产物CO2的再利用
(3)一定量的CO2与足量的碳在体积可变的恒压密闭容器中发生反应C(s)+CO2(g) ⇌2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示,则下列说法正确的是______(填字母)。
A.550℃时,若充入氢气,则v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25%
C.T℃时,若再充入等物质的量的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
已知:计算用平衡分压代替平衡浓度,气体分压(p分)=气体总压(p总)×体积分数。

-
二氧化碳的回收利用是环保领域研究的热点课题。
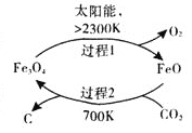
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。
(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
| 物质 | H-H | C=O | C=C | C-H | H-O |
| 能量/kJ•mol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=  ]的关系如图所示。
]的关系如图所示。
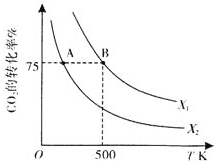
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ mol•L-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)
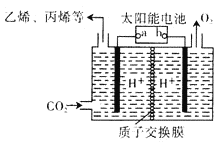
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
-
二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g) CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
| 物质 | H-H | C=O | C=C | C-H | H-O |
| 能量/kJ•mol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X=  ]的关系如图所示。
]的关系如图所示。
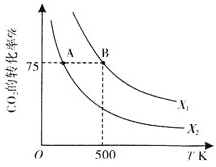
①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ mol•L-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)
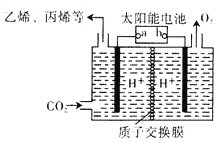
①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。
-
化学与人类生产、生活、社会可持续发展密切相关,下列说法不正确的是
A.甘油(丙三醇)可以保湿护肤
B.应大量使用化肥和农药,以提高农作物产量
C.废弃的塑料瓶属于可回收垃圾
D.用CO2合成的聚碳酸酯塑料易降解,可实现“碳”的循环利用
-
下列有关说法正确的是( )
①聚氯乙烯可使溴水褪色
②合成纤维完全燃烧只生成CO2和H2O
③甲醛、氯乙烯和乙二醇均可作为合成聚合物的单体
④合成纤维和光导纤维都是新型无机非金属材料
A.①② B.③ C.②③ D.②④
-
硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
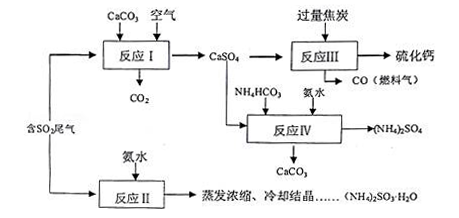
(1)写出反应Ⅰ的化学方程式________________________.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数________;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应_____________.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有__________________.
(4)根据合成流程,可以循环利用的是____________.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式___________________.
-
乙二醛(OHC—CHO)是一种重要的精细化工产品。
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为________________________;
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)⇌HOCH2CH2OH(g)△H=-78kJ•mol-1 K1
2H2(g)+O2(g)⇌2H2O(g)△H=-484kJ•mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)⇌OHC-CHO(g)+2H2O(g)的△H=_______kJ•mol-1;相同温度下,该反应的化学平衡常数K=_____(用含K1、K2的代数式表示);
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图1所示.反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____________、____________;

Ⅱ.乙二醛电解氧化制备乙醛酸(OHC-COOH)的生产装置如图2所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸.
(3)阴极反应式为____________;
(4)阳极液中盐酸的作用,除了产生氯气外,还有____________;
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=_____;
(设:法拉第常数为f Cmol-1;η= ×100% )
×100% )
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,可能发生的反应如下:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
③CH3OH(g) CO(g)+2H2(g) ΔH3
CO(g)+2H2(g) ΔH3
回答下列问题:
(1)已知反应②中相关化学键键能数据如下:
| 化学键 | H-H | C=O | C≡O | H-O |
| E/kJ·mol-1 | 436 | 803 | 1076 | 465 |
由此计算ΔH2=____kJ·mol-1。已知ΔH3=+99kJ·mol-1,则ΔH1=____kJ·mol-1。
(2)一定比例的合成气在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。
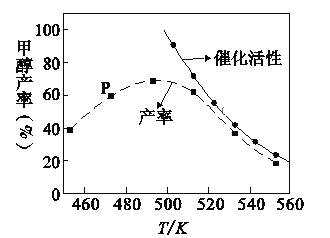
①温度为470K时,图中P点____(填“是”或“不是”)处于平衡状态。在490K之前,甲醇产率随温度升高而增大,490K之后,甲醇产率随温度升高而减小的原因分别是____。
②一定能提高甲醇产率的措施是____。
A.增大压强 B.升高温度 C.选择合适催化剂 D.加入大量催化剂
(3)如图为一定比例的CO2/H2,CO/H2、CO/CO2/H2条件下甲醇生成速率与温度的关系。
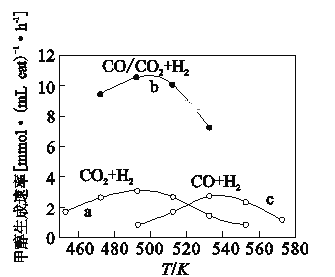
①490K时,根据曲线a、c判断合成甲醇的反应机理是____(填“I”或“II”)。
Ⅰ.CO2 CO
CO CH3OH II.CO
CH3OH II.CO CO2
CO2 CH3OH+H2O
CH3OH+H2O
②490K时,曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应①、②分析原因____。
-
甲醇是重要的化工原料,利用合成气(CO、H2、CO2)在催化剂的作用下合成甲醇,可能发生的反应如下:
① CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ/mol K1
② CO(g)+2H2(g) CH3OH(g) ΔH2=-90.77 kJ/mol K2
CH3OH(g) ΔH2=-90.77 kJ/mol K2
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3 K3
CO(g)+H2O(g) ΔH3 K3
(1)反应③的ΔH3=________,化学平衡常数K3与K1、K2的代数关系是K3=_____。
(2)要使反应②的速率和转化率都增大,需要改变的条件是___________。在5 MPa下,要提高反应②的转化率,可采取的措施有__________、_________(答两条)。
(3)若反应①在恒容密闭容器中进行,下列可以判断该反应达到平衡的是_______(填标号)。
A.v正(H2)=v逆(CH3OH) B.混合气压强不变
C.c(H2)与c(H2O)比值不变 D.混合气密度不变
(4)在一定温度和催化剂存在下,向1 L密闭容器中充入1 mol CO2和3 mol H2发生反应①。当CO2的平衡转化率为50%时,产物甲醇的体积分数为________,该温度下,正反应的平衡常数K=__________。若向容器中再充入0.5 mol H2和0.5 mol H2O(g),其他条件不变时平衡_______移动(填“正向”“逆向”“不”)。
 +H2O
+H2O键数目为______。
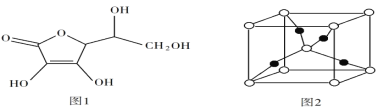










 ×100% )
×100% )
