-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ/mol,
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247.4kJ/mol,
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________________________________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
CH3OH(g)+H2O(g)。某温度下,将1molCO2和3molH2充入体积不变的2L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
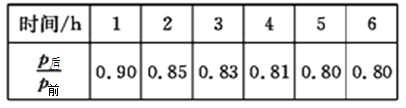
①用H2表示的前2h的平均反应速率v(H2)=_________。
②该温度下,CO2的平衡转化率为______________。
(3)在300℃、8MPa下,将CO2和H2按物质的量之比1:3通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
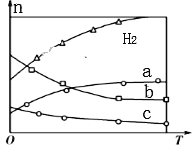
①该反应的△H_______0(填“>”或“<”)。
②曲线c表示的物质为______(填化学式)。
-
(14分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) ===2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________。
(2)硫铁矿(FeS2)燃烧产生的SO2通过下列碘循环工艺过程既能制H2SO4,又能制H2。
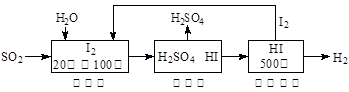
已知1g FeS2完全燃烧放出7.1 kJ热量,FeS2燃烧反应的热化学方程式为________。
该循环工艺过程的总反应方程式为________。
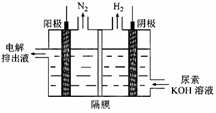
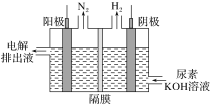
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________。
(4)用吸收H2后的稀土储氢合金作为电池负极材料(用MH表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH Ni(OH)2+M
Ni(OH)2+M
①电池放电时,正极的电极反应式为________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为________。
-
(11分)(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______________________________;
(2)在体积不变的密闭容器中进行(1)反应,达到平衡后(填“正向移动”、“逆向移动”、“增大”、“减小”或“不变”):
①扩大容器体积,平衡___________,c(H2)____________(与原平衡相比);
②升高温度,正反应速率________ ,逆反应速率___________;
体系的压强__________,平衡___________,平衡常数_____________;
③加入催化剂,H2的物质的量___________________。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)+2H2O(g) =CO2(g) +4H2(g)△H= 。
(2)实验室用Zn和稀硫酸制取H2,若向反应体系中加入少量下列试剂能加快产生H2速率的是( )。

A.HNO3(浓) B.CH3COONa(固体)
C.Na2SO4 (固体) D.CuSO4(固体)
(3)有一种燃料电池,利用细菌将有机酸转化成氢气,氢气进入有氢氧化钾溶液的燃料电池中发电。电池负极反应式 。燃料电池与普通燃烧过程相比,优点是 。
(4)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。请写出
①负极电极方程式 。
②电池总反应方程式 。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)= CO(g)+3H2(g) ΔH =+206.2 kJ·mol-1
CH4(g)+CO2(g)= 2CO(g)+2H2(g) ΔH =+247.4 kJ·mol-1
2H2S(g)= 2H2(g)+2S (g) ΔH =+169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为______。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是__________。燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:____________。
(3)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图如图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极),碳元素的电解产物最终被碱液吸收生成碳酸根。电解时,阴、阳极的电极反应式分别为____________, _______________。
-
(8分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+ H2O(g)  CO(g)+3H2(g) Δ H =-206.2kJ·mol-1
CO(g)+3H2(g) Δ H =-206.2kJ·mol-1
CH4(g)+ CO2(g)  2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2CO(g)+2H2(g) ΔH =-247.4kJ·kJmol-1
2H2S(g)  2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1
2H2(g)+S2(g) ΔH =+169.8kJ·kJmol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_____________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是__________________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式: _____________________。
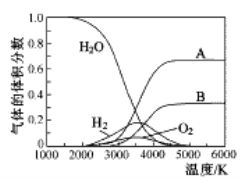
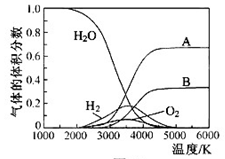
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是______________。
-
(1)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH=+169.8 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)Na2S的水溶液洗患处可以用来治疗由一种小芥虫在皮肤内生活引起的皮肤病,而且用热水配制的Na2S溶液治疗效果更好。请说明原因 ,并写出有关的化学方程式 。
(3)某自来水中含有Ca2+、Mg2+、Na+、K+、HCO、SO、Cl-,长期烧煮上述自来水会在锅炉内形成水垢。锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。
已知部分物质20 ℃时的溶解度数据:
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度/(g/100 g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
①请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:______________________。
②锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去。试剂X是________(填序号)。
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述) _______________________________。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究特点。
已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1
CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1
CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
2H2S(g) 2H2(g)+S2(g) ΔH=+169.8 kJ·mol−1
2H2(g)+S2(g) ΔH=+169.8 kJ·mol−1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为____________________________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
______________________________。
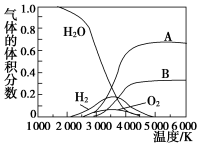
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________________________________________________。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)热分解法制氢。某温度,H2O(g)  H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
(2)热化学循环制氢。制备H2的反应步骤如下:
①Br2(g) + CaO(s) = CaBr2(s) + 1/2O2(g) ΔH=-73 kJ·mol-1
②3FeBr2(s) + 4H2O(g) = Fe3O4(s) + 6HBr(g) + H2(g) ΔH=+384 kJ·mol-1
③CaBr2(s) + H2O (g) = CaO(s) + 2HBr(g) ΔH=+212 kJ·mol-1
④Fe3O4(s)+8 HBr(g) = Br2(g) + 3FeBr2(s) + 4H2O(g) ΔH=-274 kJ·mol-1
则 H2O(g)  H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
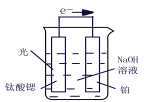
(3)光电化学分解制氢,钛酸锶光电极:4OH--4e-  O2+2H2O,则铂电极的电极反应为_______。
O2+2H2O,则铂电极的电极反应为_______。
(4)水煤气法制氢。CO(g) + H2O(g)  CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。
① 若升高温度到950℃时,达到平衡时K_________1(填“>”、“<”或 “=”)。
② 850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是_________。
(5)甲烷制氢。将1.0 mol CH4和2.0 mol H2O (g)通入容积为100 L的反应室,在一定条件下发生反应:CH4(g) + H2O (g)=CO (g) + 3H2(g)。测得达到平衡所需的时间为5 min,CH4的平衡转化率为50%,则用H2表示该反应的平均反应速率为_____。
(6)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种非金属单质。该反应的化学方程式为_____。
-
(16分)肼(N2H4)又称联氨,是一种可燃性液体,与氧气或氮氧化物反应均可生成氮气和水。氢气是一种清洁能源,液氢和肼均可用作火箭燃料。
Ⅰ 氢气的制取与储存是氢能源利用领域的研究热点。
已知: (g)+
(g)+  (g)=
(g)= (g)+
(g)+ (g)
(g)  = +
= +

 (g)+
(g)+  (g)=
(g)= (g)+
(g)+ (g)
(g) = +
= +

(1)氢气作为新能源的优点________。(答2点)
(2)以甲烷为原料制取氢气是工业上常用的制氢方法。 (g)与
(g)与 (g)反应生成
(g)反应生成 (g)和
(g)和 (g)的热化学方程式为________。
(g)的热化学方程式为________。
(3)H O的热分解也可得到H
O的热分解也可得到H ,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________ 、 ________。
,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________ 、 ________。
Ⅱ(4)肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,负极的电极反应式是。
(5)下图是一个电化学装置示意图。用肼一空气燃料电池做此装置的电源。

①如果A是铂电极,B是石墨电极,C是硫酸—硫酸铵,阴极的电极反应式是________。
②利用该装置可制得少量过氧化氢:在阳极上SO42—被氧化成S2O82—(过二硫酸根离子),S2O82—与H2O反应生成H2O2,S2O82—+2H2O=2SO42—+H2O2+2H+。若要制取2molH2O2,该燃料电池理论上需消耗________molN2H4。
(6)由A、B、C、D四种金属按下表中装置进行实验。
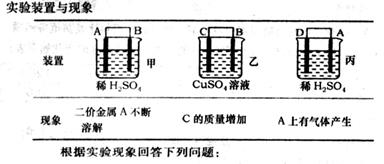
①装置丙中溶液的P H________。(填“变大”“变小”或“不变”)
②四种金属活泼性由弱到强的顺序是________。
H2(g)+1/2O2(g)。该反应平衡常数表达式K=_____
H2(g)+1/2O2(g) ΔH =_________kJ·mol-1。
O2+2H2O,则铂电极的电极反应为_______。

CO2(g)+ H2(g) ΔH <0,在850℃时,K=1。










