-
CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g) C(ads)+2H2 (g) (慢反应)
C(ads)+2H2 (g) (慢反应)
反应②:C(ads)+ CO2(g) 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
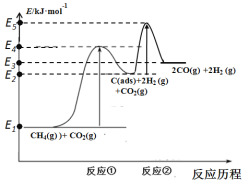
(1)CH4与CO2制备“合成气”的热化学方程式为_________。能量变化图中:E5+E1_________E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+ (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________(填标号)。
A < B
B  C >
C > D 无法确定
D 无法确定
-
CO2的回收与利用是科学家研究的热点课题。可利用CH4与CO2制备合成气(CO、H2),还可制备甲醇、二甲醚、低碳烯经等燃料产品。
I.科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)⇌C(ads) +2H2(g) (慢反应)
反应②:C(ads) + CO2(g)⇌2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
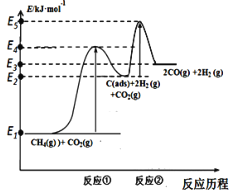
(1)CH4与CO2制备合成气的热化学方程式为____________:该反应在高温下可自发正向进行的原因是_________,能量变化图中:E5+E1___E4+E2(填“>”、“<”或“=”)。
II.利用“合成气”合成申醇后,脱水制得二甲醚。
反应为:2CH3OH(g)⇌CH3OCH3 (g) + H2O(g) △H
经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+ 。其速率方程为:v正=k正•c2(CH3OH),v逆=k逆•c(CH3OCH3)•c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正•c2(CH3OH),v逆=k逆•c(CH3OCH3)•c(H2O),k正、K逆为速率常数,且影响外因只有温度。
(2)反应达到平衡后,仅升高温度,k正增大的倍数________ k逆增大的倍数(填“>”、“<”或“= ”)。
(3)某温度下,Kc=200,在密闭容器中加入一定量CH3OH。反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_____(埴标号)
A. B.
B. C.
C. D.无法确定
D.无法确定
Ⅲ.合成低碳烯经
(5)强碱性电催化还原CO2制备乙烯研究取得突破进展,原理如图所示。b极接的是太阳能电池的_______极(已知PTFE浸泡了饱和KCl溶液)。请写出阴极的电极反应式______。
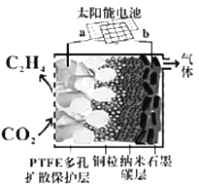
-
CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备:“合成气”反应历程分两步:
反应①: CH4(g)⇌C(ads)+2H2(g) (慢反应)
反应②:C(ads)+CO2(g)⇌2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如下图:
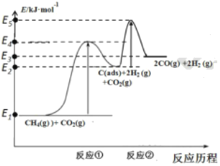
(1) CH4与CO2制备“合成气”的热化学方程式为____。 能量变化图中:E5+E1_______E4+ E2(填“>” 、 “< ” 或 “= ”)。
II.甲醇合成
在某 CO 催化加氢制甲醇的反应体系中,发生的主要反应有:
i. CO2(g) + 3 H2(g)⇌CH3OH(g)+H2O(g)△H1< 0
ii.CO2(g) + H2(g)⇌CO (g)+H2O(g) △H2>0
iii . CO(g)+2H2( g)⇌CH3OH(g) (g) △H3< 0
(2)5MPa 时,往某密闭容器中按投料比n(H2) :n ( CO2) =3:1 充入H2和CO2。反应达到平衡时, 测得各组分的物质的量分数随温度变化的曲线如图所示。
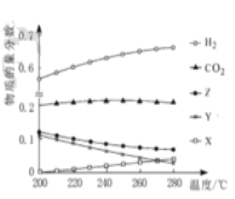
①体系中CO2的物质的量分数受温度的影响不大, 原因是_____。
②250°C时,反应 i i 的平衡常数____1(填“> ”“< ”或“=”)
③下列措施中,无法提高甲醇产率的是____(填标号)。
A.加入适量CO B.增大压强 C.循环利用原料气 D.升高温度
④在下图中画出n(H2)/ n(CO2)随温度变化趋势图_____。
(3)反应i可能的反应历程如下图所示。
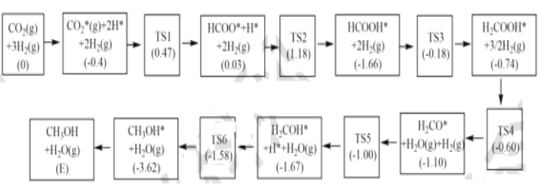
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中TS表示过渡态、*表示吸附在催化剂上的微粒,反应历程中,生成甲醇的决速步骤的反应方程式为__。
-
二氧化碳捕集、存储和转化是当今化学研究的热点问题之一。
(1)CO2转化途径之一是利用太阳能或生物质能分解水制H2,然后将H2与CO2转化为甲醇(CH3OH)、二甲醚(CH3OCH3)等。已知:
甲醇合成反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1
二甲醚合成反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.5kJ·mol-1
则由H2和CO2制备二甲醚2CO2(g)+6H2(g)=CH3OCH3(g) +3H2O(g)的△H____kJ·Mol-1
+3H2O(g)的△H____kJ·Mol-1
(2)甲醇是一种可再生的清洁能源,具有开发和应用的广阔前景。
已知:25℃,1.01×105Pa时,1.6g液态甲醇完全燃烧,当恢复到原状态时,放出36.29kJ的热量,写出表示甲醇燃烧热的热化学方程式________________________________。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下,将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O+2H+;2HNO2+O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1.0g铵态氮元素转化为硝态氮元素时需氧气的质量为_______g。
②写出加入甲醇后反应的离子方程式:_______________________________________。
-
“低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g)△H=-41kJ·mol-1
H2(g)+CO2(g)△H=-41kJ·mol-1
②CH4(g) C(s)+2H2(g)△H=+73kJ·mol-1
C(s)+2H2(g)△H=+73kJ·mol-1
③2CO(g) C(s)+CO2(g)△H=-171kJ·mol-1
C(s)+CO2(g)△H=-171kJ·mol-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=
CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z= ]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
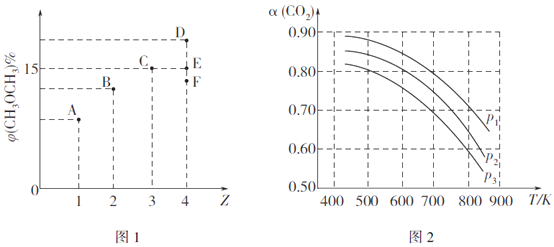
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施
有________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
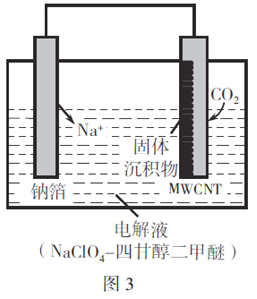
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
-
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题。
Ⅰ.CO2可以与H2反应合成C2H4,该转化分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ·mol-1
CO(g)+H2O(g) △H=+41.3kJ·mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
C2H4(g)+2H2O(g) △H=–210.5kJ·mol-1
(1)CO2与H2反应反应合成乙烯的热化学方程式为___。
(2)一定条件下的密闭容器中,要提高CO2合成乙烯的转化率,可以采取的措施是____(填标号)。
①减小压强 ②增大H2的浓度 ③加入适当催化剂 ④分离出H2O(g)
(3)己知温度对CO2合成乙烯的平衡转化率及催化剂的催化效率的影响如图所示,下列说法正确的是____(填标号)。
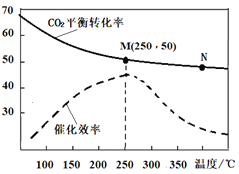
①N点的速率最大
②M点的平衡常数比N点的平衡常数大
③温度低于250℃时,随温度升高乙烯的平衡产率增大
④实际反应尽可能在较低的温度下进行,以提高CO2的转化率
Ⅱ.研究表明CO2和H2在一定条件下可以合成甲醇,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
CH3OH(g)+H2O(g)[反应①]。一定条件下,往2L恒容密闭容器中充入2.0mo1CO2和4.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如图所示:
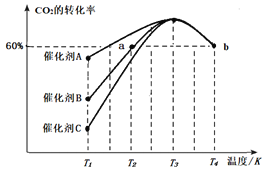
(4)催化效果最佳的是催化剂____(填“A”、“B”或“C”)。
(5)T2温度下,若反应进行10min达到图中a点状态,用CO2的浓度表示的反应速率v(CO2)=____。
(6)图中b点已达平衡状态,则该温度下反应的平衡常数K=____。
(7)在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应:CO2(g)+H2(g) CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
CO(g)+H2O(g)[反应②]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得如下实验数据:
| T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
| 543 | 12.3 | 42.3 |
| 553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。表中数据说明,升高温度CO2的实际转化率提高而甲醇的选择性降低,其原因是____。
-
二氧化碳的回收利用是环保领域研究的热点课题。
(1)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g) △H
C2H4(g)+4H2O(g) △H
在0.1 MPa时,按n(CO2)︰n(H2)=1︰3投料,如图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
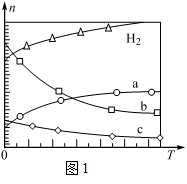
①该反应的△H________0(填“>”、“=”或“<”)。
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 。
(2)向2L恒容密闭容器中充入2 mol CO2(g)和n mol H2(g),在一定条件下发生(1)中反应。CO2的转化率与温度、投料比【X= n(H2)/ n(CO2)】的关系如图2所示:
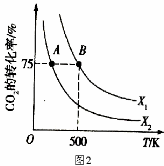
① X1 X2(填“<”、“>”或“=”,下同),平衡常数K(A) K(B)。
② 若B点的投料比为3,则平衡常数K(B)为 (结果保留小数后一位)。若反应从开始到B点需要10 min,则v(H2)= 。
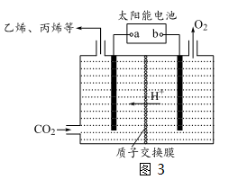
(3)在强酸性的电解质水溶液中,惰性材料做电极,利用太阳能将CO2转化成低碳烯烃,工作原理如图3所示。
① 该工艺中能量转化方式主要有 。
② b为电源的__________(填“正”或“负”)极,电解时,生成丙烯的电极反应式是 。
(4)以CO2为原料制取碳(C)的太阳能工艺如图4所示。
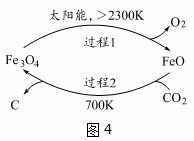
①过程1中发生反应的化学方程式为 。
②过程2中每生成1mol Fe3O4转移电子的物质的量为 。
-
CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25 ℃,1.01×105Pa下测定):
①CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) ΔH =-49.01
CH3OH(l) + H2O(l) ΔH =-49.01  kJ·mol-1
kJ·mol-1
②2CH3OH(l)  CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
CH3OCH3(g) + H2O(l) ΔH =-24.52 kJ·mol-1
③CO(g) + H2O(l)  CO2(g) + H2(g) ΔH = -41.17 kJ·mo
CO2(g) + H2(g) ΔH = -41.17 kJ·mo l-1
l-1
(1)工业上用CO2和H2合成二甲醚的热化学方程式为_____________________________________。
(2)反应①的平衡常数表达式K=____________。
(3)在一常温恒容的密闭容器中,放入一定量的甲醇发生如②式化学反应并建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据的是__________(填字母)。
A.容器内气体相对分子质量保持不变
B. 容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍
D.甲醇和二甲醚物质的量相等
(4)在三个体积相同的密闭容器中加入相同物质的量的CO和H2O,在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:
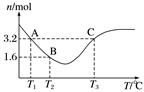
Ⅰ.A、C两点的速率大小v(A)________(填“大于”“小于”“等于”或“无法判断”)v(C)。
Ⅱ.请解释曲线中CO的物质的量先减小后增大的原因______________________________________________。
(5)一定量的CO2和H2在一密闭容器中发生反应①,下图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整(t1时刻升温;t2时刻添加催化剂)。__________________
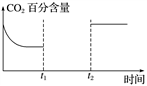
-
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
|   时间/min 时间/min
物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
①3—4min之间,化学平衡向___ ____反应方向移动(填“正”或“逆”)。
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
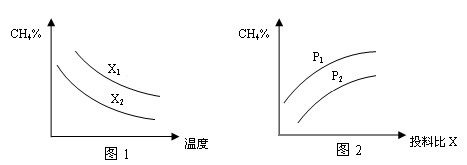
①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
-
Ⅰ.CO2的转化一直是全球研究的热点,其中将CO2和H2合成甲醇及二甲醚 (CH3OCH3)具备相对成熟的技术。工业生产中,有以下相关反应
①CO2(g) + 3H2(g)  CH3OH(l) + H2O(l) △H < 0
CH3OH(l) + H2O(l) △H < 0
②2 CH3OH(l)  CH3OCH3(g) + H2O(l) △H < 0
CH3OCH3(g) + H2O(l) △H < 0
③CO(g) + H2O(l)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
(1)在一常温恒容的密闭容器中,放入一定量的甲醇如②式建立平衡,以下说法正确并可以作为该反应达到平衡状态的判断依据为________。
A.容器内气体相对分子质量保持不变
B.容器内气体压强不变
C.相同时间内消耗甲醇的量是消耗二甲醚的两倍;
D.甲醇和二甲醚物质的量相等
(2)在三个体积相同的密闭容器A,B,C中加入相同物质的量的CO和H2O在不同温度下发生反应③,经过相同时间后测得容器中的CO物质的量与温度的关系如下图:

① A、B两点的速率大小v(A)___v(B)(填“大于”、“小于”、“等于”、“无法判断”)
② 请解释曲线中CO的物质的量先减小后增大的原因________________________。
(3)一定量的CO2和H2在一密闭容器中发生反应①,下左图是容器内CO2的百分含量随着外界条件改变的变化曲线图,请补充完整。(t1时刻升温;t2时刻加催化剂)______
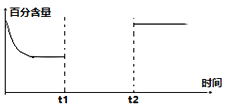

Ⅱ.SO2的尾气处理通常用电化学处理法
(4)①如上右图所示,Pt(Ⅱ)电极的反应式为__________________;
②当电路中转移0.02mole-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加_____mol离子。




















