-
氯化亚铁是重要的还原剂,常用于检测硒、生产聚合氯化铝铁絮凝剂。制备FeCl2的方法有多种。请回答下列问题:
Ⅰ.结晶法制取FeCl2
在一定浓度的盐酸中,逐渐加入过量的铁屑,充分反应后,蒸发至出现晶膜,____,______,固液分离,洗涤,快速干燥制得。
Ⅱ.氯苯还原无水FeC13制取FeC12
无水FeCl3与氯苯反应的化学方程式为:2FeCl3+C6H5Cl 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
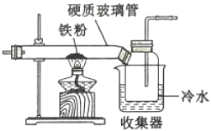
(1)如图是用干燥的C12和铁粉制取无水FeC13的装置。硬质玻璃管和收集器用大口管连接的原因是________。
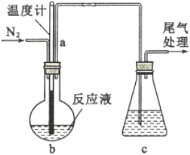
(2)利用如图装置制备无水FeC12,并检测FeC13的转化率。已知相关物质的部分性质如下:
| C6H5C1(氯苯) | C6H4C12 | FeC13 | FeC12 |
| 相对分子质量 | 112.5 | 147 | 162.5 | 127 |
| 熔点/℃ | -45 | 53 | 306 | 670~674 |
| 沸点/℃ | 132 | 173 | 315 | 1023 |
将162.5 g无水氯化铁和200 g氯苯加入到圆底烧瓶中,在锥形瓶中加入200 g滴有酚酞的9.5%的NaOH溶液。先通入N2一段时间,再加热,控制温度在132 ℃左右发生反应。实验完成后冷却,分离提纯得到粗产品。
①先通入N2的目的是_______;导管a的作用是______。
②当锥形瓶内溶液颜色由红色变为无色时,停止加热,则氯化铁转化率理论上达到或超过______%。
③实验结束后,回收过量氯苯的操作名称为______。
④指出装置c可能存在的缺点______。
-
氯化亚铁常用于检测硒、污水处理等。制备FeCl2 的方法有多种。
(1)在一定量的盐酸中,逐渐加入一定量的铁屑,若二者恰好完全反应。再向溶液中加入_____________然后保存溶液。
(2)用H2还原无水FeCl3制取FeCl2, 装置如下:

已知:FeCl2、FeCl3易吸水。
①H2 还原无水FeCl3制取FeCl2的化学方程式为__________________________________。
②上述仪器的连接顺序为( 可多次使用)______________,C中盛放的试剂是___________________。
(3)按下图装置,用162.5g无水氯化铁和225g 氯苯,控制反应温度在一定范围加热3 h。冷却,分离提纯得到粗产品。反应为2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl。

已知:
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯 |
| 熔点/℃ | -45 | 53 | _________ | _________ |
| 沸点/℃ | 132 | 173 | _________ | _________ |
①仪器A的名称是____________;下列装置可以代替装置C的是_____________(填字母)。

②反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl中,氧化产物是_________________________。
③反应的温度最好控制在_______________左右。
④反应结束后,冷却实验装置,将仪器A 内物质经过过滤洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_________________________。
⑤通过烧杯中的现象变化就可以监控氯化铁的转化率。若要监控氯化铁转化率达到或超过80%,则烧杯中试剂为加有酚酞且理论上至少含_______g NaOH 的溶液。
-
无水氯化铝是一种重要的有机合成催化剂,还可用于金属冶炼、润滑油合成;食品级无水氯化铝也可用作膨松剂、絮凝剂等。
某研究性学习小组查阅资料后利用下图所示装置制备无水氯化铝。
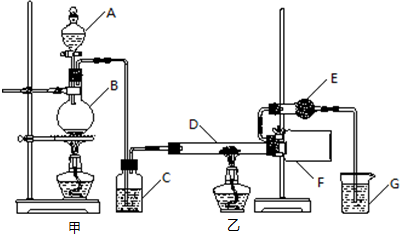
资料显示:氯化铝为无色透明晶体或白色而微带浅黄色的结晶性粉末,在178℃升华,其蒸气是缔合分子(Al2Cl6),在空气中能吸收水分,发生水解。
(1)填写下列仪器的名称:A________,B________。
(2)装置C中盛装的试剂是________;装置G中盛装的试剂是________。
(3)相同条件下,氯化铝蒸气对氢气的相对密度是________。
(4)装置F中的现象是________。
(5)装置E的作用是。
(6)实验结束后应先撤去________(填“甲”或“乙”)处的酒精灯。
-
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。若酸性FeCl2废液中c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol ·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________。
·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________。
-
[化学――选修2:化学与技术]草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含两个结晶水)的工艺流程如下:
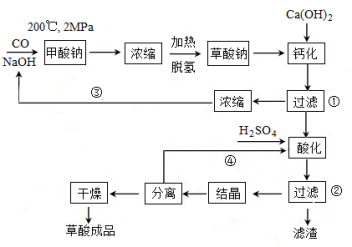
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为 、 。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是 ,滤渣是 _____;过滤操作②的滤液是 __和 ,滤渣是________ 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水,用0.0500mol/L的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。
-
[化学—选修2:化学与技术](15分)
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
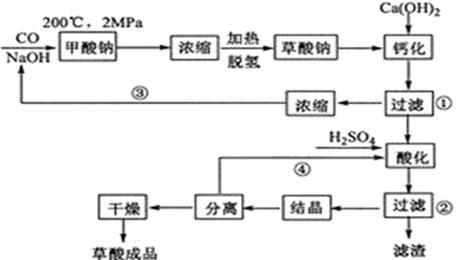
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为________、________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是________,滤渣是________;过滤操作②的滤液是________和________,滤渣是________。
(3)工艺过程中③和④的目的是________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 mol?L-1的酸性KMnO4溶液滴定,至粉红色不消褪,消耗KMnO4溶液15.00mL,反应的离子方程式为________;列式计算该成品的纯度________。
-
莫尔盐[(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。回答下列问题:
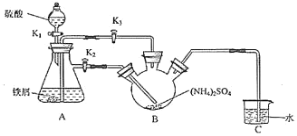
Ⅰ.制取莫尔盐:
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中__________(填仪器名称),将6.0g洁浄铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol•L-1稀硫酸后关闭K1.A装置中反应的离子方程式为______________。
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为___________________________________。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、___、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为_______________________________。
④装置C的作用为___________________,装置C存在的缺点是____________________。
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加入稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mLKMnO4溶液。滴定反应的离子方程式为_______________________,该样品的纯度为______。
-
莫尔盐[(NH4)2Fe(SO4)2・6H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
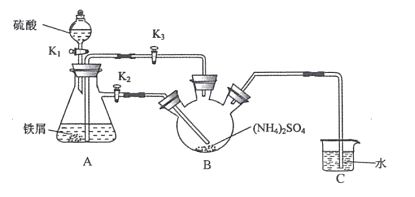
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______(填仪器名称),将6.0g洁浄铁屑加人锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为 ____,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加人稀硫酸,用0.1mol・L-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____,该样品的纯度为____
-
[化学-选修2:化学与技术]
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产.一种制备草酸(含2个结晶水)的工艺流程如下: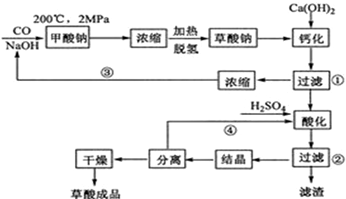
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______2MPaHCOONa
-
关于下列各装置图的叙述中,正确的是

A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生还原反应
2FeCl2+C6H4Cl2+HCl↑











