-
研究化学反应的能量变化和速率变化是研究化学反应的重要角度。
(1)化学反应中能量变化的主要原因是旧的化学键断裂会_____能量;新的化学键形成会_____能量。(填“放出”或“吸收”)
(2)用铝热法可冶炼铁,其反应为:Fe2O3+2Al 2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。
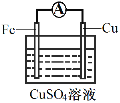
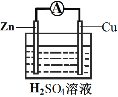
(3)为探究反应过程中的能量变化,某小组同学用如图装置进行实验。
| 
| 
|
| 装置Ⅰ | 装置Ⅱ |
①装置Ⅰ中,Fe与CuSO4溶液反应的离子方程式是_____。
②装置Ⅱ中,正极的电极反应式为______。
③关于装置Ⅱ,下列叙述正确的是______(填字母)。
a.H+在Cu表面被还原,产生气泡
b.电流从Zn片经导线流向Cu片
c.电子从Zn片经导线流向Cu片
d.Zn和Cu的都是电极材料,也都参与电极反应
(4)某兴趣小组将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是_____。

A.从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高
B.从t1→t2的原因水蒸发,致使酸的浓度升高
C.从t2→t3的原因是随着反应的进行镁条的质量下降
D.从t2→t3的原因是随着反应的进行,H+的浓度逐渐下降
-
下列关于化学键的说法正确的是( )
A.化学键是分子与分子之间的作用力
B.形成物质中的化学键时,要吸收能量
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.化学反应中能量变化的主要原因是形成或断裂同一种化学键,放出或吸收的能量不相等
-
下列说法错误的是( )
A.化学键的断裂和形成是化学反应中能量变化的主要原因
B.放热反应和吸热反应决定于反应物的总能量与生成物的总能量的相对大小
C.化学反应中能量变化,通常主要表现为热量的变化——放热或者吸热
D.凡经加热而发生的化学反应都是吸热反应
-
下列说法中错误的是
A.所有的化学反应都伴随着物质变化和能量变化
C.断裂化学键要吸收能量、形成化学键要释放能量是化学反应中能量变化的主要原因
C.吸热反应是一定需要加热才能发生的反应
D.根据反应物总能量和生成物总能量的相对大小可判断反应是释放能量还是吸收能量
-
下列说法正确的是
A.化学键的变化必然会引起能量变化,所以能量变化也一定会引起化学变化
B.原电池放电过程中,负极质量一定减轻,正极的质量一定增加
C.化学键的断裂和形成是物质在化学反应中能量变化的主要原因
D.有能量变化的过程不是发生吸热反应就是发生放热反应。
-
下列说法中错误的是 ( )
A. 化学反应中的能量变化通常表现为热量的变化
B. 化学键的断裂和形成是化学反应中能量变化的主要原因
C. 需要加热才能发生的反应一定是吸热反应
D. 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
-
下列关于化学键的说法正确的是( )
A.化学键是分子与分子之间的作用力
B.形成物质中的化学键时,要吸收能量
C.化学键的断裂和形成是化学反应中能量变化的主要原因
D.形成或断裂同一种化学键,放出或吸收的能量是不相等的,这是化学反应中能量变化的主要原因
-
下列说法中错误的是
A.化学反应中的能量变化通常表现为热量的变化
B.化学键的断裂和形成是化学反应中能量变化的主要原因
C.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量
D.需要加热才能发生的化学反应一定是吸热反应
-
下列关于能量变化的说法正确的是
A. 冰融化成水放出热量
B. 金属与酸反应吸收能量
C. 生成物的总能量一定低于反应物的总能量
D. 化学键的断裂和形成是化学反应中能量变化的主要原因
-
下列关于能量变化的说法正确的是
A. 冰融化成水放出热量 B. 生成物的总能量一定低于反应物的总能量
C. 金属与酸反应吸收能量 D. 化学键的断裂和形成是化学反应中能量变化的主要原因
2Fe+Al2O3,属于放热反应,反应物的总能量______(填“>”、“=”或“<”)生成物的总能量。在该反应中,若消耗了1molAl,则理论上可炼制Fe的物质的量为_____mol。

