-
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢.当它们混合时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出过氧化氢的电子式__________.
(2)写出该反应的化学方程式:______________________________.
(3)16g液态肼与足量液态过氧化氢反应生成氮气和水蒸气时,放出的热量为__________kJ.
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是:________________________________________.
高一化学填空题中等难度题查看答案及解析
-
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢。当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出肼的结构式 ,过氧化氢的电子式 。
(2)写出该反应的热化学方程式: 。
(3)已知H2O(1) = H2O(g) △H=+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量为 kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是: 。
(5)发射卫星可用气态肼为燃料,二氧化氮做氧化剂,两者反应生成氮气和水蒸气。
已知: N2(g)+2O2(g) = 2NO2(g) △H=+67.7kJ·mol-1…………①
N2H4(g)+O2(g) = N2(g) +2H2O(g) △H=-543kJ·mol-…………②
请选择书写气态肼和二氧化氮反应的热化学方程式的计算表达式可以为:
A.①-②×2 B.①×2-② C.②×2-① D.②-①×2
高一化学填空题困难题查看答案及解析
-
(12分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态过氧化氢反应,生成氮气和水蒸气,放出256.0kJ的热量。
(1)写出过氧化氢和肼的电子式:过氧化氢________,肼________。
(2)写出液态肼与足量液态过氧化氢反应生成氮气和气态水反应的热化学方程式________。
(3)已知H2O(1)=H2O(g) △H =+44kJ/mol,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________ kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是________。
高一化学填空题简单题查看答案及解析
-
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)=2NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)==N2(g)+2H2O (g);△H= -534kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:______________________。
高一化学综合题中等难度题查看答案及解析
-
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量N2和水蒸气,并放出大量热,已知0.4mol液态肼与足量液态H2O2反应,生成氮气和水蒸气,放出256.65KJ热量.
(1)写出该反应的热化学方程式______.
(2)已知H2O(l)=H2O(g)-44KJ,则16g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是______KJ.
(3)上述反应用于火箭推进器,除释放出大量热和快速产生大量气体外,还有一个很突出的优点是______.高一化学解答题中等难度题查看答案及解析
-
在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)=H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)=2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g);△H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式___________。
(5)已知: ①N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ/mol
②N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
③1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
④H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
(6)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量。
b 与a、c、d的数学关系式是______________。
高一化学填空题简单题查看答案及解析
-
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量。
(1)该反应的热化学方程式为____________________________________________。
(2)又知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________。
高一化学填空题中等难度题查看答案及解析
-
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 。
(2)已知H2O(l)
H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g)
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g)
N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼和二氧化氮反应的热化学方程式为________ 。
高一化学填空题中等难度题查看答案及解析
-
Ⅰ.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知:0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)该反应的热化学方程式为_______________________________________。
(2)又知H2O(l)=H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与液态双氧水反应生成液态水时放出的热量是________kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大的优点是________________________。
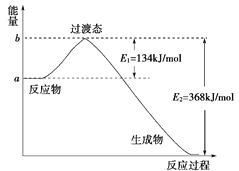
Ⅱ.参考下列图表和有关要求回答问题。
(1)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________________;
(2)下表是部分化学键的键能数据:
化学键
P—P
P—O
O=O
P=O
键能/(kJ/mol)
a
b
c
x
已知白磷的燃烧热ΔH=-d kJ/mol,白磷及其完全燃烧的产物结构如图所示,则上表中x=______________________(用含有a、b、c、d的代数式表示)。

高一化学综合题中等难度题查看答案及解析
-
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.6KJ的热量。
(1)反应的热化学方程式为________。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是________KJ。
(3)肼与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20%---30%的氢氧化钾溶液,写出该电池放电时的电极反应:
正极 ________负极________
高一化学填空题中等难度题查看答案及解析