-
铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.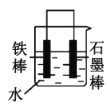 B.
B.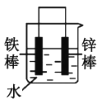 C.
C.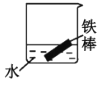 D.
D.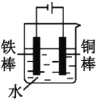
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
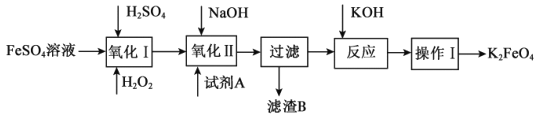
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
-
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍.写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:______.铁锈的主要成分是______(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______.
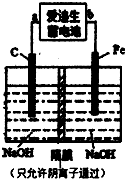
(2)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是______(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是______.
②写出在用电解法制取高铁酸钠时,阳极的电极反应式______.
③你认为高铁酸钠作为一种新型净水剂的理由可能是______.
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质.
-
铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
-
铜铁是目前人们使用量最大的合金材料,铁及其化合物也是人们日常生活中应用广泛的一类物质。回答下列问题:
(1)下图中铁钉发生的电化学腐蚀类型是________,负极反应式为__________。
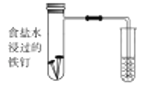
(2)实验室配置 溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________,
溶液时,需向溶液中滴加几滴稀硫酸,其目的是__________, 溶液中离子浓度由大到小的顺序是________。
溶液中离子浓度由大到小的顺序是________。
(3)高铁盐酸是一种新型的环境消毒剂及水体净化剂,如高铁酸钾( )。其中
)。其中 的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则
的化合价是________,其净水过程中既表现出强氧化性,又表现了强吸附性,则 与水反应的离子方程式为__________。
与水反应的离子方程式为__________。
(4)羰基铁酸[ ]是一种二元弱酸,其第一步电离方程式为__________。
]是一种二元弱酸,其第一步电离方程式为__________。
(5)25℃时,向含 的溶液中加入一定量的
的溶液中加入一定量的 后,
后, 恰好达到溶液平衡,测得溶液的
恰好达到溶液平衡,测得溶液的 ,
, 。通过计算判断所得的
。通过计算判断所得的 中是否含有
中是否含有 杂质:________(已知:
杂质:________(已知: ,
, )
)
-
铁及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)钢铁的腐蚀
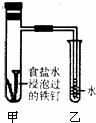
钢铁在潮湿的空气中被腐蚀的负极反应式为:________;将经过酸洗除锈的铁钉,用饱和食盐水浸泡后,放入如图所示装置中,下列叙述正确的是________
A.过一段时间,乙试管中的导管内水柱上升
B.甲试管中铁钉发生了化学腐蚀
C.铁钉在该装置中被腐蚀的情况随时间的延长而加快
(2)生铁中含有一种铁碳化合物X( Fe3C). X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是:________;X与过量浓硝酸反应后溶液中含有的盐的化学式________.
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ的名称是________,操作Ⅱ的名称是________;
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)________;
③请完成生成FeCO3沉淀的离子方程式:Fe2++HCO3- FeCO3↓+________+H2O;
④写出在空气中煅烧FeCO3的化学方程式________.
-
铁及其化合物在生产、生活中具有广泛的用途。请回答下列问题:
(1)氰化物极毒, 可以消除含氰废液中的
可以消除含氰废液中的 ,其中
,其中 的电子式为________。
的电子式为________。
(2)碳酸亚铁 是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣
是一种重要的工业盐,外观为白色固体,潮湿空气中易被氧化。用硫铁矿烧渣 主要含
主要含 、
、 、少量
、少量 制备
制备 的工艺流程如下:
的工艺流程如下:
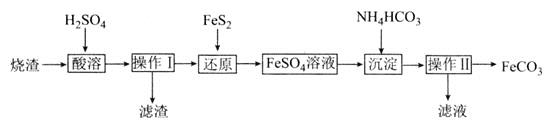
 “还原”时,发生反应的离子方程式为________。
“还原”时,发生反应的离子方程式为________。
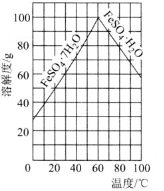
 的溶解度曲线如图所示,欲获得
的溶解度曲线如图所示,欲获得 ,采用的实验操作是________。
,采用的实验操作是________。
 在空气中煅烧可制备铁红,反应的化学方程式为________。
在空气中煅烧可制备铁红,反应的化学方程式为________。
 “沉淀”步骤中
“沉淀”步骤中 达到沉淀溶解平衡时,若
达到沉淀溶解平衡时,若
 ,欲使所得的
,欲使所得的 中不含有
中不含有 ,应调节溶液的pH不超过________
,应调节溶液的pH不超过________ 已知:
已知: ,
, ,
, 。
。
(3)铁 镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为
镍电池结构、强度极好,循环寿命和工作寿命长。电池总反应为 。写出放电时的负极反应式:________。
。写出放电时的负极反应式:________。
(4)化合物 为
为 价
价 为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
为亮绿色晶体,可用于晒制蓝图。其组成测定实验如下:
步骤Ⅰ:称取0.491g 置于锥形瓶中,加足量蒸馏水和稀
置于锥形瓶中,加足量蒸馏水和稀 ;
;
步骤Ⅱ:用
 溶液进行滴定,恰好反应时消耗
溶液进行滴定,恰好反应时消耗 溶液
溶液 ;
;
步骤Ⅲ:再加入适当的还原剂,将 完全转化为
完全转化为 ,用
,用 溶液继续滴定,当
溶液继续滴定,当 完全氧化时,消耗溶液
完全氧化时,消耗溶液 溶液2.00mL。
溶液2.00mL。
 步骤Ⅰ中加足量稀
步骤Ⅰ中加足量稀 的目的是________。
的目的是________。
 该化合物的化学式为________。
该化合物的化学式为________。
-
(14分)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________(填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________(填答案编号)。

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是 、(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②E装置的作用是,
上述装置最后尾气处理的方法是。
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =。
④在本实验中,下列情况会使测定结果n偏大的是________ (填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
-
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4 CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________(填答案编号)。
CO↑ + CO2↑ + H2O,下列装置中,可用作草酸分解制取气体的是________(填答案编号)。
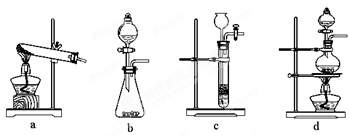
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是________、________(填答案编号)。
a. 浓硫酸 b.澄清的石灰水 c. 氢氧化钠溶液 d. 无水氯化钙
②E装置的作用是________,
上述装置最后尾气处理的方法是________。
③准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =________。
④在本实验中,下列情况会使测定结果n偏大的是________ ________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
-
全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因。
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为_____________。
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4  CO↑ + CO2↑ + H2O,
CO↑ + CO2↑ + H2O,
下列装置中,可用作草酸分解制取气体的是______(填答案编号)。

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3·nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示。

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是_______、
________(填答案编号)。
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)____________。
③E装置的作用是______________________________________________________,
上述装置最后尾气处理的方法是_____________。
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32 g,D中浓硫酸增重0.72 g,则n =_____________。
⑤在本实验中,下列情况会使测定结果n偏大的是__________(填答案编号)。
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3·nH2O
-
铁及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)钢铁在潮湿的空气中发生吸氧腐蚀的正极反应式为 。
(2)生铁中含有一种铁碳化合物X(Fe3C),X在足量的空气中高温煅烧,生成有磁性氧化物Y,Y可溶于过量盐酸,形成黄绿色的溶液,写出Y与盐酸反应的化学方程式 。
(3)某炼铁废渣中含有大量CuS及少量铁的化合物,工业上以该废渣为原料生产CuCl2·H2O的工艺流程如下:

已知:Fe(OH)2、Fe(OH)3、Cu(OH)2沉淀完全时的pH值分别为9.7、3.3、6.4。
试回答下列问题:
①试剂F应选用 (填编号)。
A.Cl2 B.NaClO C.HNO3 D.浓硫酸
理由是 。
②为了获得晶体,对滤液B进行的操作是蒸发浓缩,趁热过滤,滤液经冷却结晶,过滤得到产品。分析有关物质的溶解度曲线(如图),“趁热过滤”得到的固体是 。

 B.
B. C.
C. D.
D.















