-
工业上用钛精矿(主要成分TiO2,矿粉中含有Fe,Al,Si,V等氧化物)制备海绵钛的基本思路是:氯化法生产TiCl4、还原、真空蒸馏法制备海绵钛(Ti)。
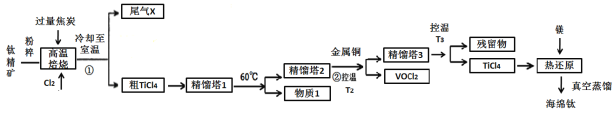
已知:①氯化过程中,其他元素均转化为最高价氯化物;
②热还原过程中,可能会有副产物TiCl3;
③常见物质熔沸点
| 化合物 | TiCl4 | SiCl4 | FeCl3 | AlCl3 | VOCl3 | VOCl2 | MgCl2 | Ti | Mg |
| 沸点 | 136 | 56 | 308 | 180(升华) | 134 | 168 | 1412 | 3260 | 1090 |
| 熔点 | -69 | -25 | 304 | 190 | -78.9 | —— | 712 | 1668 | 648.9 |
回答下列问题:
(1)将钛精矿粉粹的目的是:_______________
(2)氯化过程中,TiO2发生的化学方程式①是:_____________
(3)物质1是________,步骤②中金属铜的作用是将VOCl3还原成VOCl2,其目的是_____________;
(4)工业上常用Mg或H2作还原剂,在Ar气氛下采用热还原法制海绵钛。
①镁不足时,TiCl4会因有副产物产生而导致产率会下降,副反应的化学方程式为_____________;此处采用真空蒸馏法除去海绵钛中的Mg和MgCl2,不采用常压蒸馏的原因是_______。
②根据图象,计算1173K时,反应2H2+TiCl4 =Ti+4HCl的△G=_________。
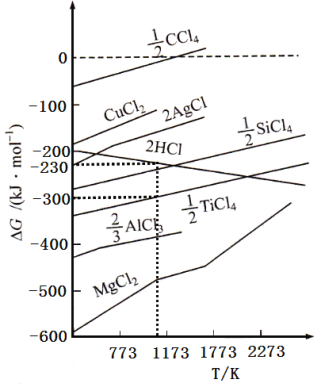
(G为自由能,图中△G是指在一定温度下,由单质生成对应物质的量化合物时的自由能变化。设此温度下,单质的生成自由能变化为0)
-
[2017·北京]TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 |
| | | | | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH2=−220.9 kJ·mol−1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
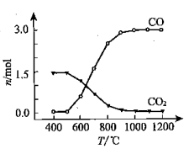
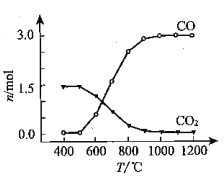
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
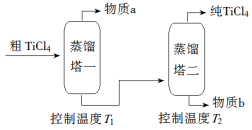
物质a是______________,T2应控制在_________。
-
(13分)
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 |
| | | | | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:

物质a是______________,T2应控制在_________。
-
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
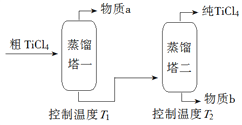
物质a是______________,T2应控制在_________。
-
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
| 熔点/℃ | −69 | −25 | 193 | 304 | 714 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 |
| | | | | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。

③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:

物质a是______________,T2应控制在_________。
-
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
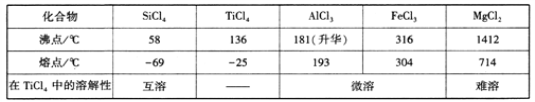
(1)Ti是一种活泼金属,原子核内有22个质子,它在周期表中的位置是____________。
(2)根据上表信息推测TiCl4中含有的化学键类型是_______________。
(3)MgCl2的电子式为____________。
(4)氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_________________。
(5)精制过程:粗TiCl4经两步蒸馏得纯TiCl4如图。
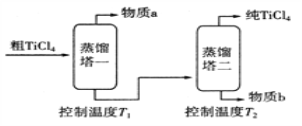
①物质a是__________________(填化学式)。
②T1应控制在______________________。
-
钛酸钡(BaTiO3)是电子陶瓷器件的重要基础原料。工业上以钛精矿(主要成分为TiO2)和BaCl2为主要原料制备钛酸钡粉体的工艺流程如下:
已知:①TiCl4水解生成H2TiO3沉淀;
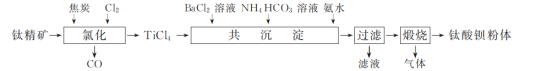
②水溶液中含碳微粒随pH的分布如图所示。
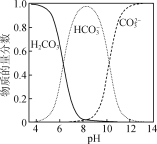
(1) “氯化”在800 ℃时进行,其反应的化学方程式为________。
(2) “共沉淀”时,需控制溶液pH为10~11,其原因是:①___________;② ________。
(3) “滤液”中溶质的主要成分为________(填化学式)。过滤得到的固体通常用一定浓度的NH4HCO3溶液进行洗涤,其主要原因是___________。
(4) “煅烧”得到的钛酸钡粉体中钡钛质量比 ,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
,钛酸钡粉体中可能含有的杂质为____________(填化学式)。
-
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg  Ti+2MgCl2
Ti+2MgCl2
对于上述两个反应的叙述正确的是
A.都是氧化还原反应 B.都是置换反应
C.反应中钛元素都被还原 D.加热时金属钛和氩气(Ar)能反应
-
四氯化钛是制取海绵钛和氯化法钛白(二氧化钛)的主要原料,用于制造颜料和钛有机化合物以及国防上用的烟幕剂。同时也是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3,含有少量Fe2O3、SiO2、Al2O3等杂质),制备TiCl4等产品的一种工艺流程如下:
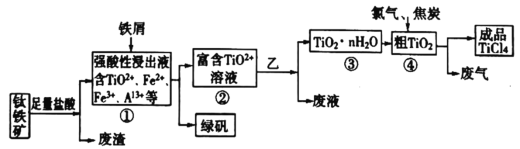
已知:
Ⅰ.①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe===3Fe2+、2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O、Ti3+(紫色)+ Fe3++ H2O===2TiO2+(无色)+ Fe2++2H+;
Ⅱ.四氯化钛的熔点-25.0℃,沸点136.4℃,SiCl4的熔点-68.8℃,沸点57.6℃。
回答下列问题:
(1)用盐酸酸浸时,为使酸浸速率加快,可采取的措施是:________________(至少写2条),发生主要反应的离子方程式为:___________。
(2)废渣的成分是_______。
(3)如何检验富含TiO2+溶液中是否还含铁元素_____________。
(4)若将制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应 的平衡常数K=____。
的平衡常数K=____。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_______(只要求写出一项)。
(6)要精制含少量SiCl4杂质的TiCl4,可采用的方法是_______。
(7)用TiCl4水解生成TiO2·nH2O,经过滤、水洗除去其中的Clˉ,再烘干、焙烧除去水分得到粉体TiO2.写出TiCl4水解生成TiO2·nH2O的化学方程式__________________。
-
钛合金是航天航空工业的重要材料.由钛铁矿(主要成分是TiO2和Fe的氧化物)制备TiO2等产品的一种工艺流程示意如下:
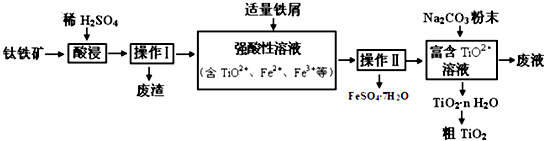
已知:①TiO2+易水解,只能存在于强酸性溶液中
②TiCl4的熔点-25.0℃,沸点136.4℃;SiCl4的熔点-68.8℃,沸点57.6℃
回答下列问题:
(1)写出钛铁矿酸浸时,主要成分TiO2反应的离子方程式 ,加入铁屑的作用是 。
(2)操作Ⅱ包含的具体操作方法有 。
(3)(3)向“富含TiO2+溶液”中加入Na2CO3粉末得到固体TiO2·nH2O,请用恰当的原理和化学用语解释其原因 ,废液中溶质的主要成分是 (填化学式).
(4)用金红石(主要含TiO2)为原料,采用亨特(Hunter)法生产钛的流程如下:
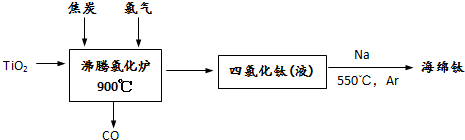
写出沸腾氯化炉中发生反应的化学方程式 ,制得的TiCl4液体中常含有少量SiCl4杂质,可采用 方法除去.
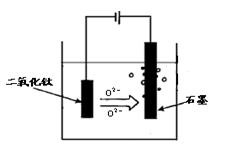
(5)TiO2直接电解法生产金属钛是一种较先进的方法,电解液为某种可以传导O2-离子的熔融盐,原理如图所示,则其阴极电极反应为: ,电解过程中阳极电极上会有气体生成,该气体可能含有 .





















