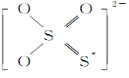-
碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
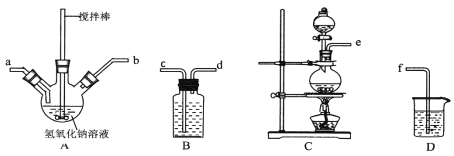
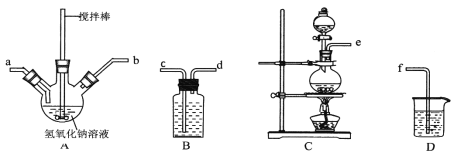
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
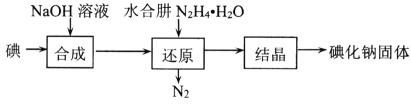
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
-
碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
-
碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。

若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
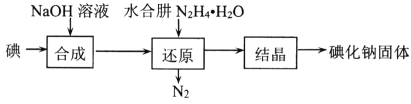
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
-
碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH= N2H4·H2O +NaCl+Na2CO3
①制取次氯酸钠和氢氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为____。
②制备水合肼时,应将__________滴到__________中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
③尿素的电子式为__________________
(2)碘化钠的制备:采用水合肼还原法制取碘化钠固体,其制备流程如图所示:

在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为 ___。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00 g样品并溶解,在500 mL容量瓶中定容;
b.量取25.00 mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c. 用0.2000 mol·L−1的 Na2S2O3标 准 溶 液 滴 定 至 终 点(反 应 方 程 式2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00 mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
-
碘化钠在医疗及食品方面有重要作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH=N2H4·H2O+NaCl+Na2CO3
①制备次氯酸钠和氢氧化钠混合液装置的连接顺序为 ________________(按气流方向用小写字母表示)。

②若该实验温度控制不当,反应后测得三颈烧瓶内ClO-与ClO3-的物质的量之比为1:5,则Cl2与NaOH反应时,被氧化的氯元素与被还原的氯元素物质的量之比为_______________。
③制备水合肼时,应将_____________________滴到 ________________中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
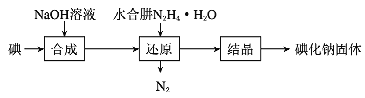
在“还原”过程中,主要消耗反应过程中生成的副产物IO ,该过程的化学方程式为 _______________________________________________。
,该过程的化学方程式为 _______________________________________________。
工业上也可用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是 ___________________________________________________________________________________。
(3)测定产品中碘化钠含量的实验步骤
a、称取10.00g样品并溶解,在250mL容量瓶中定容;
b、量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后再加入X溶液作指示剂;
c、用0.2100mol·L-1的Na2S2O3标准液滴定至终点(2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准液体积为15.00mL。
①S2O 的结构式如图所示,其中S*的化合价为____________。
的结构式如图所示,其中S*的化合价为____________。
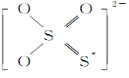
②X溶液为 ___________ ;滴定终点的现象为 __________________。
③该样品中NaI的质量分数为_________。
-
碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①A中盛装氢氧化钠溶液的仪器名称为______________,制取次氯酸钠和氧氧化钠混合液的连接顺序为_______________________(按气流方向,用小写字母表示)。
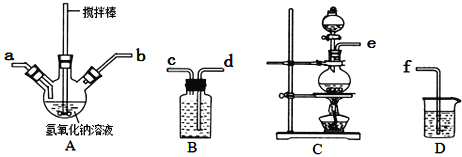
若该实验温度控制不当,反应后测得三颈瓶内ClO−与ClO3−的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到到另一种溶液中(填“NaClO溶液”或“尿素溶液”),且该溶液应该________滴加。(填“快速”或“不宜过快”)
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
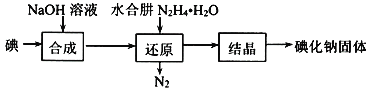
在“还原”过程中,主要消耗反应过程中生成的副产物IO3−,该过程的离子方程式为______________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是______________
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L−1的Na2S2O3标准溶液滴定至终点(反应方程式为:2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
-
碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备。
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
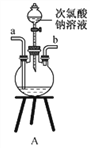
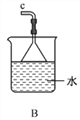
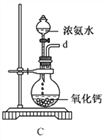
②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备。
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
-
碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
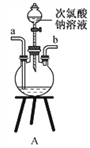
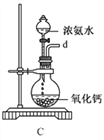
②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是_______________________________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
-
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)
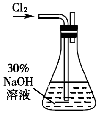
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是 。
实验二: 制取水合肼。(实验装置如图所示)
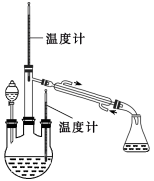
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
蒸馏时需要减压,原因是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
-
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)+2NaOH+NaClO = Na2CO3+N2H4·H2O+NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)
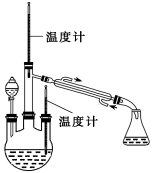
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO = N2↑+3H2O+2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量
水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25. 00 mL于锥形瓶中,加入10 mL水,摇匀.
c.用0.2000 mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 ;
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”) ;若本次滴定消耗碘的标准溶液为18.00 mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。


,该过程的化学方程式为 _______________________________________________。
的结构式如图所示,其中S*的化合价为____________。