-
废弃物的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64kJ•mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196kJ•mol-1
H2(g)+ O2(g)═H2O(l)△H=-285kJ•mol-1
O2(g)═H2O(l)△H=-285kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为__________________
(2)①在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl(氯化亚铜)沉淀,同时溶液的酸性增强.制备CuCl的离子方程式是___________
②在 硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时, ________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
③若在0.15 硫酸铜溶液中通入过量
硫酸铜溶液中通入过量 气体,使
气体,使 完全沉淀为CuS,此时溶液中的
完全沉淀为CuS,此时溶液中的 浓度是______
浓度是______
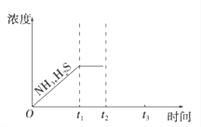
(3)工业上常用氨水吸收H2S进行废气脱硫,生成NH4HS。一定温度下1molNH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。下图1是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图1上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线_________________________。
(4)可利用H2S废气进行高温热分解制取氢气,实现化废为宝。
已知:
在恒温密闭容器中,控制不同温度进行 分解实验。以
分解实验。以 起始浓度均为0.2
起始浓度均为0.2  测定
测定 的转化率,结果见下图。
的转化率,结果见下图。
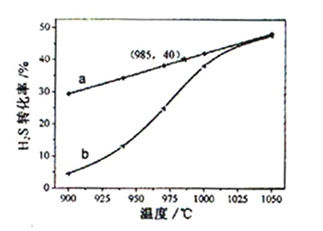
图中a为 的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时 的转化率。据图计算985℃时
的转化率。据图计算985℃时 按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
-
废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末
(1)废旧印刷电路板中回收的铁是新型电池的使用材料,如制成LiFePO4电池,它可用于电动汽车。电池反应为:FePO4+Li  LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。放电时其正极反应方程式为:
(2)用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
则在H2SO4 溶液中Cu 与H2O2 反应生成Cu2+和H2O的热化学方程式为:________。
(3)部分金属的回收需要氧化性很强的溶液,如金常用________和________的混合溶液溶解
(4)为了分离金属粉末常用到氰酸(HCN)溶液,HCN是一种有毒且较弱的酸,已知:常温下HCN的电离程度非常小,其Ka=6.2×10-10,0.1mol/L的NaCN的pH=11.1,0.1mol/L的NH4CN的pH=9.2, 则浓度都是0.1mol/L的NaCN和NH4CN溶液中,CN-水解程度大小为:NaCN________NH4CN(填:> = < ),理由是:
-
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+
-
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ•mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ•mol-1 ═H2O(l)H=-285.84KJ•mol-1
═H2O(l)H=-285.84KJ•mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率
| 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______.
-
(7分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是________(填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,写出该反应的离子
方程式为。
(3)控制其他条件相同,印刷电路板的金属粉末用10℅H2O2和3.0mol·L-1H2SO4的混合
溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol·L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是________
________。
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉
淀。制备CuCl的离子方程式是________。
-
(15分)铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
________
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围,向反应后溶液中加入4mol/L NaOH溶液________ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为________ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量________g。(用含a的代数式表示)
-
铝、铁、铜是应用最普遍的金属。
(1)铜是印刷电路工业的重要材料。用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,是工业上采用的方法之一。已知
Cu(s) + 2H+(aq) == Cu2+(aq) + H2(g) △H= +64.39kJ/mol
2H2O2(l) == 2H2O(l) + O2 (g) △H= ﹣196.46kJ/mol
H2(g) +1/2 O2 (g)== H2O(l) △H= ﹣285.84kJ/mol
在H2SO4溶液中Cu和H2O2反应生成Cu2+和H2O的热化学方程式为
________
(2)镁铝合金生活中应用广泛。取样品a克,溶于200ml 5mol/L的HCl溶液,收集到标况下氢气3.36L,a的取值范围________,向反应后溶液中加入4mol/L NaOH溶液ml,沉淀质量达到最大值。
(3)标准状况下,铁铜合金ag加入足量稀硝酸中,收集了一定量气体NO,在混合了67.2mlO2后,可完全被H2O吸收,无气体剩余。则生成的NO为________ml;向反应后溶液加足量的NaOH溶液,得到沉淀的质量________ g。(用含a的代数式表示)
-
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
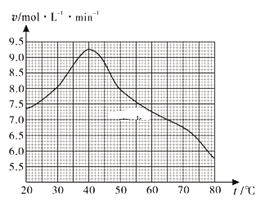
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2 g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
-
(8分)研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=+64.39kJ•mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ•mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ•mol-1
在H2SO4溶液中Cu与H2 O2反应生成Cu2+和H2O的热化学方程式为______________。
O2反应生成Cu2+和H2O的热化学方程式为______________。
(2)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
①已知0.4 mol KB rO3在反应中得到2 mol电子生成X,则X的化学式为_______;该反应的还原剂及其配平后的系数是_____。
rO3在反应中得到2 mol电子生成X,则X的化学式为_______;该反应的还原剂及其配平后的系数是_____。
②根据上述反应可推知_______。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
-
15.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H= +64.39kJ·mol-1
②2H2O2(l)=2H2O (l)+O2(g) △H= -196.46kJ·mol-1
③H2(g)+O2(g)=H2O(l) △H= -285.84kJ·mol-1
下列有关说法错误的是( )
A.铜可以溶解于稀盐酸与H2O2的混合溶液
B.铜溶解于酸性双氧水的热化学方程式为:
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) △H= —319.68 kJ·mol-1
C.反应①是在任何条件下都不可能发生的化学反应
D.用H2O2和H2SO4的混合溶液溶解铜比用浓硫酸溶解铜环保
O2(g)═H2O(l)△H=-285kJ•mol-1
硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=9时,
________ mol/L(已知Ksp[Cu(OH)2]=2.2×10-20)
硫酸铜溶液中通入过量
气体,使
完全沉淀为CuS,此时溶液中的
浓度是______

分解实验。以
起始浓度均为0.2
测定
的转化率,结果见下图。

的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时
的转化率。据图计算985℃时
按上述反应分解的平衡常数K=______(保留2位有效数字);说明随温度的升高,曲线b向曲线a逼近的原因:_________________________。
