-
以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4,含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
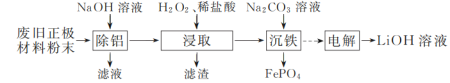
(1)“除铝”时反应的离子方程式为______________________________。
(2)试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:______。
(3)“浸取”所得滤液中,磷元素的存在形式主要是________(填字母)。
a. PO b. H3PO4 c. H2PO
b. H3PO4 c. H2PO
(4)“沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是_____________________。
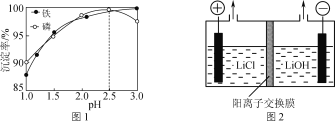
(5)“电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是________________________________________。
(6)LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:__________________。
-
磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。一种回收废旧磷酸亚铁锂电池正极片(主要成分LiFePO4、炭黑和铝箔)中金属的流程如下:

(1)步骤①中“碱溶”反应的化学方程式为_____。
(2)步骤②中反应的离子方程式为_____。若用H2O2代替HNO3,其优点是_____。
(3)步骤③沉淀的主要成分是_____。
(4)步骤④中生成含Li沉淀_____(填“能”或“不能”)用硫酸钠代替碳酸钠,原因是_____。
-
磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:
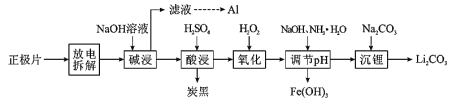
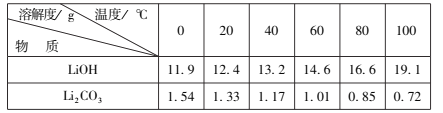
已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
-
磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如下:

已知:碳酸锂在水中的溶解度,0℃时为1.54g,90℃时为0.85g,100℃时为0.71g。
(1)上述流程中至少需要经过______次过滤操作。
(2)“氧化”发生反应的离子方程式为__________;若用HNO3代替H2O2不足之处是_____。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为________mol/L。
②实际生产过程中,“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如下表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=________。
(4)“沉锂" 时的温度应选(填标号)______为宜,并用___洗涤(填“热水" 或“冷水")。
a.90℃ b.60 ℃ c.30 ℃ d.0 ℃
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为________。
(6)工业上可以用FePO4、Li2CO3和H2C2O4作原料高温焙烧制备 LiFePO4,该反应的化学方程式为________
-
以经预处理的废旧磷酸亚铁锂电极(主要成分为LiFePO4、 Al、C)为原料,生产Li2CO3 的部分工艺流程如下:
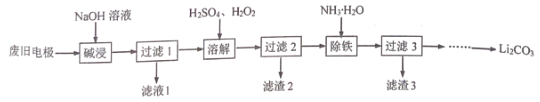
已知:LiFePO4难溶于水和碱性溶液,可溶于酸性溶液。Li2CO3溶于稀酸,微溶于水。下列说法不正确的是
A.滤渣2的主要成分为C
B.溶解时发生反应的离子反应方程式:2LiFePO4+2H++H2O2=2Li++2Fe3++ 2 + 2H2O
+ 2H2O
C.向过滤3的滤液中加入饱和Na2CO3溶液即可生成Li2CO3沉淀
D.已知将Li2CO3、FePO4•x H2O、H2C2O4 混合反应可重新获得LiFePO4,理论上完全反应消耗的n(Li2CO3):n(FePO4•x H2O):n(H2C2O4)=1:2:1
-
近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、氨水为主要原料制备FePO4的流程如下图。

已知:H3PO4是弱电解质
(1)将FeCl3溶液与H3PO4溶液按 混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
混合,没有明显现象,逐渐滴加氨水至pH = 1.5左右,生成FePO4·2H2O沉淀。
①操作a为______。
②生成FePO4·2H2O的离子方程式是______。
③控制氨水用量,避免因pH偏高而产生______杂质。
(2)测定产物样品中铁元素的质量分数,主要步骤如下:
i.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2(还原剂)至溶液呈浅黄色;
ii.加入TiCl3,恰好将i中残余的少量Fe3+还原为Fe2+;
iii.用c mol·L–1 K2Cr2O7标准溶液滴定Fe2+,消耗v mLK2Cr2O7标准溶液。
①将步骤iii的离子方程式补充完整:
____ +____Fe2++___=____Cr3++____Fe3++____;
+____Fe2++___=____Cr3++____Fe3++____;
②产物中铁元素的质量分数为_____。
-
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂LiTi5012和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
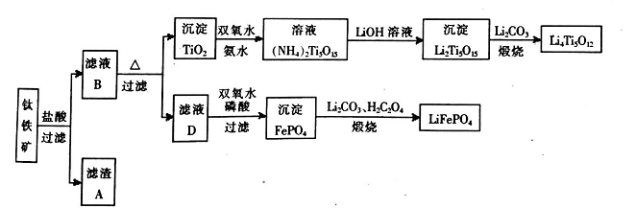
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(I)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是____ 。滤渣A的熔点大于干冰的原因是 。
(3)滤液B中TiOCI42-转化生成Ti02的离子方程式是 。
(4)由滤液D制备LiFeP04的过程中,所需17%双氧水与H2C204的质量比是 。
(5)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4 LiTi5012+3FePO4。该电池充电时阳极反应 .
LiTi5012+3FePO4。该电池充电时阳极反应 .
-
废弃锂离子电池的资源化处理日益重要。从废旧磷酸铁锂电池的正极材料(含LiFePO4、石墨粉和铝箔等)中综合回收锂、铁和磷等的工艺流程如图所示:
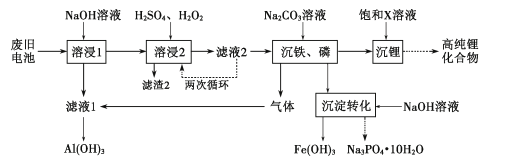
有关数据:25℃时,Ksp(FePO4)=1.3×10-22、Ksp[Fe(OH)3]=2.6×10-39。
回答下列问题:
(1)“溶浸1”中铝溶解的化学方程式为___。
(2)完成“溶浸2”反应的离子方程式___:
 LiFePO4+
LiFePO4+ H2O2+
H2O2+ =
= Li++
Li++ +
+ H2PO4-+
H2PO4-+ H2O
H2O
(3)“滤渣2”的主要成分是___。
(4)“滤液2”循环两次的目的是___。
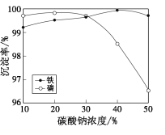
(5)“沉铁、磷”时,析出FePO4沉淀,反应的离子方程式为__。实验中,铁、磷的沉淀率结果如图所示。碳酸钠浓度大于30%后,铁沉淀率仍然升高,磷沉淀率明显降低,其可能原因是___。
(6)“沉淀转化”反应:FePO4+3OH-⇌Fe(OH)3+PO43-。用此反应的化学平衡常数说明转化能否完全___?
(7)为了充分沉淀,“沉锂”时所用的X和适宜温度是___(填标号)。
A.NaOH20-40℃ B.NaOH80-100℃
C.Na2CO320-40℃ D.Na2CO360-80℃
-
(14分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:

已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是_______。
(2)滤渣A的成分是_______。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是_______ 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因_ 。

(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是_______。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:
Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
-
(12 分)钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
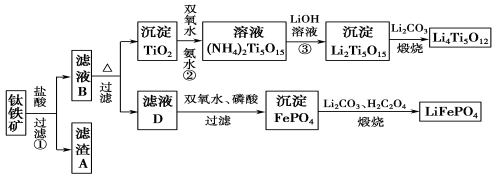
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-===Fe2++TiOCl42-+2H2O。
(1)若在实验室中煅烧固体混合物,会用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有 (填仪器名称)。流程中多次涉及沉淀,则洗涤沉淀的方法是 。
(2)生产中利用滤渣A制备半导体的反应是 。
(3)滤液B中TiOCl42-转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度有关,反应温度过高时,Ti元素浸出率会下降,其原因是 。
(5)写出由滤液D生成FePO4的离子方程式 。由滤液D制备LiFePO4的过程中,所需双氧水与H2C2O4的物质的量比是 。

b. H3PO4 c. H2PO












