-
硫酸亚铁溶液和过量碳酸氢铵溶液混合,过滤、洗涤、干燥得到碳酸亚铁,在空气中灼烧碳酸亚铁得到铁的氧化物M。利用滴定法测定M的化学式,其步骤如下:
①称取3.92g样品M溶于足量盐酸,并配成100mL溶液A。
②取20.00mL溶液A于锥形瓶中,滴加KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生气泡。
③待气泡消失后,用1.0000 mol·L-1 KI标准溶液滴定锥形瓶中的Fe3+,达到滴定终点时消耗KI标准溶液10.00 mL。
(1)实验中必需的定量仪器有量筒、电子天平、____________和____________。
(2)在滴定之前必须进行的操作包括用标准KI溶液润洗滴定管、__________、___________。
(3)步骤②中“气泡”有多种可能,完成下列猜想:
①提出假设:
假设1:气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2。
假设2:气泡可能是H2O2的反应产物____________,理由___________。
②设计实验验证假设1:
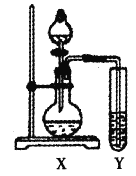
试管Y中的试剂是_______。
(4)根据上述实验,写出硫酸亚铁溶液和过量碳酸氢铵溶液混合制备碳酸亚铁的离子方程式_____。
(5)根据数据计算,M的化学式为_______。
(6)根据上述实验结果,写出碳酸亚铁在空气中灼烧的化学方程式________。
-
硫酸亚铁溶液和过量碳酸氢铵溶液混合,过滤、洗涤、干燥得到碳酸亚铁,在空气中灼烧碳酸亚铁得到铁的氧化物M。利用滴定法测定M的化学式,其步骤如下:
①称取3.92g样品M溶于足量盐酸,并配成100mL溶液A。
②取20.00mL溶液A于锥形瓶中,滴加KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生气泡。
③待气泡消失后,用1.0000 mol·L-1 KI标准溶液滴定锥形瓶中的Fe3+,达到滴定终点时消耗KI标准溶液10.00 mL。
(1)实验中必需的定量仪器有量筒、电子天平、____________和____________。
(2)在滴定之前必须进行的操作包括用标准KI溶液润洗滴定管、__________、___________。
(3)步骤②中“气泡”有多种可能,完成下列猜想:
①提出假设:
假设1:气泡可能是SCN-的反应产物N2、CO2、SO2或N2,CO2。
假设2:气泡可能是H2O2的反应产物____________,理由___________。
②设计实验验证假设1:
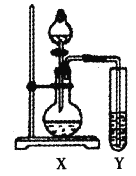
试管Y中的试剂是_______。
(4)根据上述实验,写出硫酸亚铁溶液和过量碳酸氢铵溶液混合制备碳酸亚铁的离子方程式_____。
(5)根据数据计算,M的化学式为_______。
(6)根据上述实验结果,写出碳酸亚铁在空气中灼烧的化学方程式________。
-
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下 部分操作和条件略
部分操作和条件略 :
:
Ⅰ 从废液中提纯并结晶出
从废液中提纯并结晶出
Ⅱ 将
将 配制成溶液.
配制成溶液.
Ⅲ 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含
溶液混合,得到含 的浊液.
的浊液.
Ⅳ 将浊液过滤,用
将浊液过滤,用 热水洗涤沉淀,干燥后得到
热水洗涤沉淀,干燥后得到 固体.
固体.
Ⅴ 煅烧
煅烧 ,得到
,得到 固体.
固体.
已知: 在热水中分解.
在热水中分解.
 Ⅰ中,加足量的铁屑除去废液中的
Ⅰ中,加足量的铁屑除去废液中的 ,该反应的离子方程式是 ______ .
,该反应的离子方程式是 ______ .
 Ⅱ中,需加一定量酸,该酸最好是 ______
Ⅱ中,需加一定量酸,该酸最好是 ______  运用化学平衡原理简述该酸的作用 ______ .
运用化学平衡原理简述该酸的作用 ______ .
 Ⅲ中,生成
Ⅲ中,生成 的离子方程式是 ______
的离子方程式是 ______  若
若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
 Ⅳ中,通过检验
Ⅳ中,通过检验 来判断沉淀是否洗涤干净,检验
来判断沉淀是否洗涤干净,检验 的操作是 ______ .
的操作是 ______ .
 已知煅烧
已知煅烧 的化学方程式是
的化学方程式是 现煅烧
现煅烧 的
的 ,得到
,得到 产品.若产品中杂质只有FeO,则该产品中
产品.若产品中杂质只有FeO,则该产品中 的质量是 ______
的质量是 ______  摩尔质量
摩尔质量 :
:
 160FeO
160FeO 
-
碳酸亚铁是白色难溶于水的固铁剂。某小组利用如图装置,向装置③中通入CO2至溶液pH=7,然后滴入FeSO4溶液,过滤、洗涤、干燥制得FeCO3。
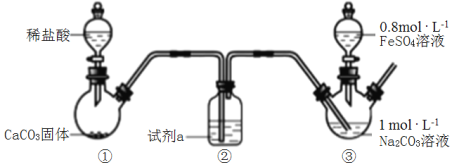
下列说法错误的是( )
A.试剂a是饱和NaHCO3溶液
B.碳酸钠溶液通入CO2至pH=7的目的是降低c(OH-),防止生成Fe(OH)2
C.装置③中生成沉淀的离子方程式为Fe2++CO =FeCO3↓
=FeCO3↓
D.碳酸钠溶液显碱性的原因是CO +H2O⇌HCO
+H2O⇌HCO +OH-
+OH-
-
碳酸亚铁在空气中灼烧得到铁的氧化物A和一种气体。某学习小组为了探究该氧化物A的组成设计了两种实验方案:
方案Ⅰ
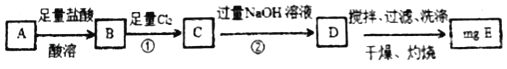
(1)若该方案中①通入Cl2不足量,小组成员认为可以通过在空气中充分搅拌D而最终实现准确测定,他的依据是_____(用化学方程式表示)
(2)若氧化物A的质量是7.8400g,E的质量为8.0000g根据数据计算化合物A的化学式为_____。
方案Ⅱ
①称取ag氧化物A样品溶于足量稀硫酸,并配成100mL溶液。
②取20.00 mL该溶液于锥形瓶中,滴加几滴KSCN溶液,溶液变红色;再滴加双氧水至红色刚好褪去,同时产生少量气泡(资料显示SCN-可被H2O2氧化,产物为N2、CO2、SO42﹣)
③待气泡消失后,用 b mol/LKI标准溶液滴定锥形瓶中的Fe3+,滴定终点时消耗cmL KI标准溶液。
(3)该方案用到的定量仪器有量筒、分析天平、酸式滴定管、_____。
(4)步骤②中滴加KSCN溶液的目的是_____。
(5)补充完整该实验步骤③用到的酸式滴定管的润洗操作:关闭滴定管旋塞,从上口注入3﹣5mL待装液,_____,重复2﹣3次。
(6)步骤③能否选用淀粉作指示剂_____。(填“能”或“否”)
(7)有的同学通过查阅相关资料对该小组的实验设计进行了评价,以下说法合理的是_____
A.资料显示:HSCN有剧毒,易挥发。因此该方案步骤②可能因产生HSCN而不符合实验安全性的要求。
B.步骤②若加入H2O2过量,后续步骤不加以处理也不会对实验结果造成任何影响。
C.资料显示:Fe3+和I﹣之间的反应是明显的可逆反应,这样步骤③就会造成滴定测定不准确
(8)有的同学对碳酸亚铁的获得产生了兴趣。通过查阅资料发现碳酸亚铁可通过碳酸氢钠和硫酸亚铁发生Fe2++2HCO3﹣⇌FeCO3↓+H2CO3制得,请计算该反应的平衡常数K=_____(mol/L)﹣2可能用到的缴据如下:Ksp(FeCO3)=3.20×10﹣11,H2CO3的Ka1=4.30×10﹣7,Ka2=5.61×10﹣11。
-
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 I 从废液中提纯并结晶处FeSO4·7H2O。
I 从废液中提纯并结晶处FeSO4·7H2O。
II将 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
 IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
固体
V煅烧 ,得到
,得到 固体
固体
 已知:
已知: 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的 ,该反应的离子方程式是________
,该反应的离子方程式是________
(2)  II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用________
II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用________
(3) III中,生成 的离子方程式是________。若
的离子方程式是________。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________。
(4)  IV中,通过检验
IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是________。
操作是是________。
(5)  已知煅烧
已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是________kg(摩尔质量/g·
的质量是________kg(摩尔质量/g· ;
; )
)
-
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略);
 I 从废液中提纯并结晶处FeSO4·7H2O。
I 从废液中提纯并结晶处FeSO4·7H2O。
II将 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含
溶液混合,得到含 的浊液
的浊液
 IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到
IV 将浊液过滤,用90°C热水洗涤沉淀,干燥后得到 固体
固体
V煅烧 ,得到
,得到 固体
固体
 已知:
已知: 在热水中分解
在热水中分解
(1) I中,加足量的铁屑出去废液中的 ,该反应的离子方程式是________
,该反应的离子方程式是________
(2)  II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用________
II中,需加一定量硫酸,运用化学平衡原理简述硫酸的作用________
(3) III中,生成 的离子方程式是________。若
的离子方程式是________。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是________。
(4)  IV中,通过检验
IV中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 操作是是________。
操作是是________。
(5)  已知煅烧
已知煅烧 的化学方程式是
的化学方程式是 ,现煅烧464.0kg的
,现煅烧464.0kg的 ,得到316.8kg产品,若产品中杂质只有
,得到316.8kg产品,若产品中杂质只有 ,则该产品中
,则该产品中 的质量是________kg(摩尔质量/g·
的质量是________kg(摩尔质量/g· ;
; )
)
-
下列离子方程式正确的是
A.酸性硫酸亚铁溶液在空气中被氧化:
B.硫酸铵溶液和氢氧化钡溶液反应:
C.碳酸氢钠溶液和过量的澄清石灰水混合:
D.酸化的 和NaI的混合溶液:
和NaI的混合溶液:
-
下列实验操作与预期实验目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向AlCl3溶液中加入过量的氨水,过滤,洗涤,干燥,加热灼烧 | 制取Al(OH)3 |
| B | 将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 | 检验气体产物中的CO2 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3- > Al(OH)3 |
| D | 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
-
下列实验操作与预期实验目的或所得实验结论一致的是
选项 实验操作 实验目的或结论
A 向AlCl3溶液中加入过量的氨水,过滤,洗涤,干燥,加热灼烧 制取Al2O3
B 将浓硫酸与碳混合加热,生成的气体通入足量的澄清石灰水 检验气体产物中的CO2
C 向某溶液中加入NaOH溶液后再加热,若产生的气体能使湿润的红色石蕊试纸变蓝, 验证该溶液中肯定有NH4+
D 将SO2通入品红溶液中,品红溶液褪色,加热褪色后的溶液,恢复红色 验证亚硫酸的不稳定性



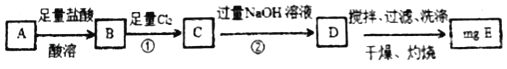
 已知煅烧
已知煅烧 已知煅烧
已知煅烧