-
钼酸钠晶体(Na2MoO4•2H2O)是白色菱形结晶体,毒性较低,对环境污染污染程度低,可作新型水处理剂和金属腐蚀抑制剂。工业上利用钼精矿(主要成分是不溶于水的 MoS2)制备钼酸钠的两种途径如图所示。
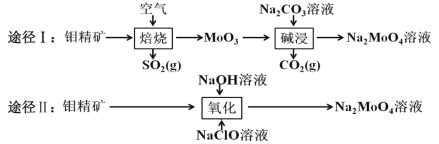
(1)途径Ⅰ焙烧过程中,为了提高焙烧效率,除增大空气量外还可以采用的措施有___; 在该过程的主要反应中,氧化剂与还原剂物质的量之比为________。
(2)途径Ⅱ氧化时还有 Na2SO4 生成,则反应的离子方程式为 ____________。
(3)已知途径Ⅰ的钼酸钠溶液中 c(MoO42-)=0.40 mol•L-1,c(CO32-)=0.10 mol•L-1。由钼酸钠溶液制备钼酸钠晶体时,需加入 Ba(OH)2 固体以除去 CO32-。在不损失 MoO42-的情况下,CO32-的最大去除率是 ____________ [已知 Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(4)途径Ⅱ中 Na2MoO4 溶液通过结晶的方法可得到 Na2MoO4 晶体。母液可以循环利用,但循环一定次数后必须对母液进行处理,试解释原因 _________。
(5)途径Ⅱ比途径Ⅰ的优点有 ________________(答出两条)。
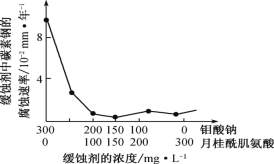
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图。
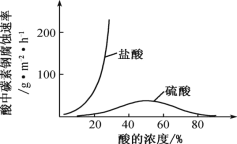
①当硫酸的浓度大于 90%时,碳素钢腐蚀速率几乎为零,原因是________________。
②若缓释剂钼酸钠-月桂酸肌氨酸总浓度为 300 mg•L-1,则缓蚀效果最好时钼酸钠(M=206 g•mol-1)的物质的量浓度为 ________(计算结果保留 3 位有效数字)。
-
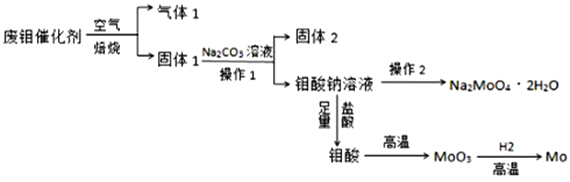
钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4∙2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S、FeS2)回收Mo并制备钼酸钠晶体,其主要流程如图所示:
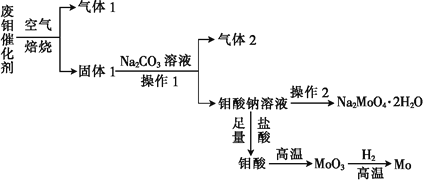
回答下列问题:
(1)可以提高焙烧效率的措施有__________________(填一条即可)。MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若生成0.1molMoO3,则反应中转移电子的数目为______。
(2)往固体1中加碳酸钠溶液,发生反应的化学方程式为_______________。
(3)操作2为______________、洗涤、干燥。
(4)制备钼酸钠晶体还可通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中还有硫酸钠生成,则反应的离子方程式为___________。
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol/L,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,溶液中c(CO32-)=_________[已知:Ksp(BaCO3)=2.6×10-9,Ksp(Ba MoO4)=4.0×10-8。忽略溶液的体积变化]。
(6)锂和二硫化钼形成的二次电池的总反应为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为____。
-
钼(Mo)是一种过渡金属元素,它具有强度高、熔点高、耐腐蚀等优点,被广泛应用于钢铁、石油、化工、电气等领域。钼酸钠晶体(Na2MoO4·2H2O)是一种新型水处理剂。某化学兴趣小组利用废钼催化剂(主要成分为MoS2,含少量Cu2S,FeS2)回收Mo并制备钼酸钠晶体,其主要流程图如图所示:
回答下列问题:
(1)可以提高焙烧效率的措施有____________________________________(填一条即可),MoS2中的钼元素在空气中焙烧,很容易被氧化成MoO3,若反应中生成0.1molMoO3,反应中转移电子的数目为____________;
(2)往固体1中加碳酸钠溶液发生反应的化学方程式为______________________________;
(3)操作2为______________________________;
(4)制备钼酸钠晶体还可用通过向精制的MoS2中直接加入次氯酸钠溶液与氢氧化钠溶液进行氧化的方法,若氧化过程中,还有硫酸钠生成,则反应的离子方程式为______________;
(5)已知钼酸钠溶液中c(MoO42-)=0.40mol•L-1,由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-,当BaMoO4开始沉淀时,CO32-的浓度为__________________;[已知:Ksp(BaCO3)=2.6×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为__________________________________。
-
钼酸钠晶体(Na2MoO4•2H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
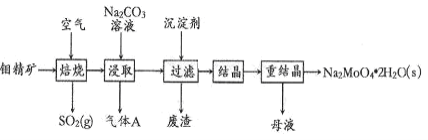
(1) Na2MoO4•2H2O中钼元素的化合价是_____;在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是_____
(2)“焙烧”时MoS2转化为MoO3,写出该反应的化学方程式:_____,反应中氧化产物是_____(填化学式)。
(3)“浸取”时含钼化合物发生反应的离子方程式为___________;“结晶”前需向滤液中加入Ba(OH)2固体以除去CO32-。若滤液中c(MoO42-)= 0.40 mol • L-1,c(CO32-)= 0.10 mol•L-1,当BaMoO4开始沉淀时,CO32-的去除率是_____% [已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×l0-8]。
(4)“分析纯”的钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与流程中所产生的气体一起通入水中,得到正盐的化学式为_____。
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示:
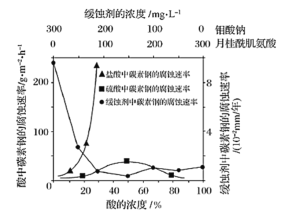
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_____
②碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是_____。
-
钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。

回答下列问题
(1)完成下列反应:_____MoS2+ _____O2 _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是__________________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为____________________________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩, 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为_____________。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_____________。
(5)空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。
A. NaNO2 B.通入适量N2 C.油脂 D.盐酸
-
钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下图。
回答下列问题
(1)完成下列反应:_____MoS2+ _____O2 _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是_____________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为___________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩, 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)操作X为_________________ ,已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X中应控制温度的最佳范围为________________。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 |  45. 45.
| |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是___。
(5)Li、MoS2 可充电电池的工作原理为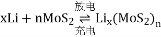 [Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
[Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
-
钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。
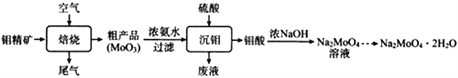
回答下列问题
(1)完成下列反应:_____MoS2+ _____O2 _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是__________________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为____________________________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩, 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为_____________。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_____________。
(5)空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。
A. NaNO2 B.通入适量N2 C.油脂 D.盐酸
-
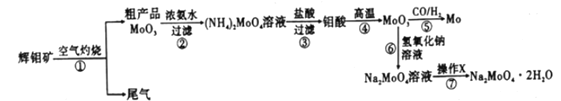
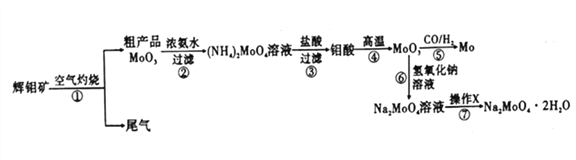
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
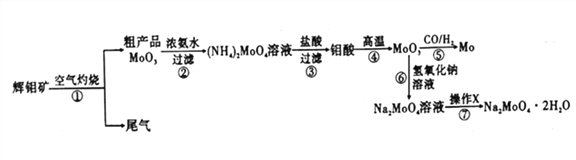
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
-
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
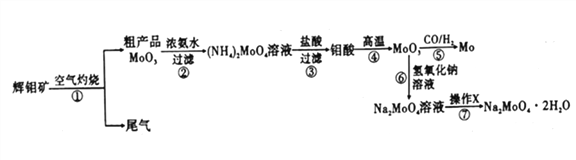
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
-
钼是一种重要的过渡金属元素,通常用作合金及不锈钢的添加剂,可增强合金的强度、硬度、可焊性等。钼酸钠晶体(Na2MoO4·2H2O) 可作为无公害型冷却水系统的金属腐蚀抑制剂,如图15 是化工生产中以辉钼矿(主要成分为硫化钼MoS2) 为原料来制备金属钼、钼酸钠晶体的主要流程图。
回答下列问题:
(1)已知反应③为复分解反应,则钼酸中钥的化合价为___________。
(2)反应⑥的离子方程式为___________。
(3)辉钼矿灼烧时的化学方程式为____________。
(4)操作X为_________。已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,则在操作X 中应控制温度的最佳范围为_______(填序号)。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O | Na2MoO4 |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0℃~10℃ B.10℃~100℃ C.15.5℃~50℃ D.100℃以上
(5)制备钼酸钠晶体还可用通过向精制的辉钼矿中直接加入次氯酸钠溶液氧化的方法,若氧化过程中,还有硫酸钠生成,则氧化剂与还原剂的物质的量之比为_________。
(6)Li、MoS2可充电电池的工作原理为xLi+nMoS2 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
(7) 可用还原性气体(CO和H2) 还原MoO3制钼,工业上制备还原性气体CO和H2的反应原理之一为CO2+CH4 2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。
2CO+2H2。含甲烷体积分数为90%的7L(标准状况)天然气与足量二氧化碳在高温下反应,甲烷转化率为80%,用产生的CO和H2 还原MoO3制钼,理论上能生产钼的质量为_________。









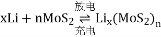 [Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。
[Lix(MOS2)n附着在电极上],则电池充电时阳极的电极反应式为_________________________ 。

 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。