-
I.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度= ,
(2)B的平均反应速率v(B)= ,
(3)x= ,
(4)开始时容器中的压强与平衡时的压强之比为 (化为最箭整数比)
II.将CH4设计成燃料电池,装置如图所示(A、B为多孔碳棒)
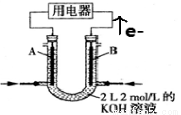
(5) (填A或B)处电极入口通甲烷,其电极反应式为 ;
(6)当消耗甲烷的体积为11.2 L(标准状况下)时,则消耗KOH的物质的量为 。
(7)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4gNH3转移的电子数目为 。
-
(9分)一定温度下,向容积为2L的密闭容器中通入3 molA和2mol B,混合气体起始压强为p0。发生如下反应:3A(g)+B(g) xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
xC(g)+ 2D(s),反应进行到1min时测得剩余1.2molA,此时C的浓度为0.6mol/L。反应进行到2min时该容器内混合气体总压强为p,5min后反应达到平衡。
(1)X为 。
(2)反应在1min内,B的平均反应速率为 ;
(3)请用p0、p来表示2min时反应物B的转化率为 %。
(4)在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是 ;
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=0.2 mol·L-1·min-1
C.v(C)=0.3 mol·L-1·min-1
D.v(D)=0.5 mol·L-1·min-1
-
一定温度下将3molA及3molB混合于2L的密闭容器中,发生如下反应3A(g)+B(g) xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.18mol/(L▪min)。求:
(1)平衡时B的浓度=___mol/L。
(2)D的平均反应速率v(D)=___mol/(L·min)。
(3)x=___。
-
在一定温度下,将 2mol A和2molB 两种气体相混合于容积为2L的某
2mol A和2molB 两种气体相混合于容积为2L的某 密闭容器中,发生如下反应:3A(g)+B(g)
密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)x值等于________________;
(2)A的转化率为 ;
(3)如果增大反应体系的压强,则平衡体系中C的质量分数 (增大、减小、不变)。
-
3mol A和2.5mol B混合于2L恒容的密闭容器中,保持温度不变发生的反应如下:3A(g)+B(g) xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
xC(g)+2D(g),反应5min达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是( )
A.A的平均反应速率为0.10mol/(L·s)
B.平衡时,B的转化率为20%
C.平衡时,C的浓度为0.125mol/L
D.平衡时,容器内压强为原来的0.8倍
-
在一定条件下,将3 mol A 和 1 mol B 两种气体混合于固定容积为 2 L 的密闭容器中,发生如下反应: 3A(g)+B(g)  xC(g)+2D(g)。 2 min 末该反应达到平衡,测得生成 0.8 mol D,0.4 molC。下列判断正确的是( )
xC(g)+2D(g)。 2 min 末该反应达到平衡,测得生成 0.8 mol D,0.4 molC。下列判断正确的是( )
A. x=2 B. 2 min 时, A 的浓度为 1.2mol·L-1
C. 2 min 内 A 的反应速率为 0.6 mol·L-1·min-1 D. B 的转化率为 60%
-
(14分)在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol。
-
在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
xC(g)+ 2D(g)。2min末该反应达到平衡,生成0.8mol D ,并测得C的浓度为0.2mol·L-1。请填空:
(1)x=__________
(2)正反应是放热反应,则升高温度,正反应速率________,逆反应速率________。(填升高、降低或不变)
(3)B的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填字母)
A. 混合气体的密度不变
B. 容器中的压强不再变化
C. 生成D的反应速率是生成B的反应速率的2倍
D. 单位时间内生成3molA,同时生成1molB
-
(14分)在一定条件下,将2molA和2molB混合于容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
xC(g)+2D(g)。2min末反应达到平衡状态时,生成0.8molD,同时测得C的浓度为0.4mol/L。请填写下列空白:
(1)x=______;用D的浓度变化表示的化学反应速率为_____________。
(2)A的平衡浓度为_______,B的转化率为__________。
(3)如果增大体系的压强,则平衡体系中C的体积分数将____(填“增大”“减小”或“不变”)。
(4)如果上述反应在相同条件下从逆反应开始进行,起始时加入C和D各 mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol
mol,要使平衡时各物质的体积分数与原平衡时完全相同,则还应加入______物质________mol
-
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
xC(g)+2D(s)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol/L。下列判断正确的是( )
A.x =1
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应一定达到平衡状态
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
