-
能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=______________。
(2)已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
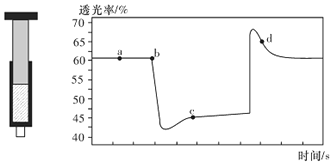
A.b点的操作是压缩注射器
B.d 点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
-
能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2(g)和3mol H2(g) | 1mol CH3OH(g)和1mol H2O(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出29.4kJ | 吸收a kJ |
①下列情况能说明该反应一定达到平衡状态的是_________(填字母)。
a.v(CO2)消耗=v(CH3OH)生成 b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变 d.气体的平均相对分子质量不再随时间改变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_________(填字母)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
③cl_________c2(填“>”、“<”或“=”),a=_________。
④该温度下反应的平衡常数K=_________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=_________。
(2)已知反应:2NO2(红棕色) N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
N2O4(无色)△H<0。将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是__________(填字母)。
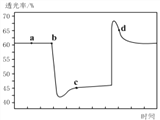
A.b点的操作是压缩注射器
B.d 点:v正>v逆
C.c点与a点相比,c(NO2)增大,c(N2O4)减小
D.若不忽略体系温度变化,且没有能量损失,则Tb>Tc
-
合成气(主要成分为CO、CO2和H2)是重要的化工原料,可利用合成气在催化剂存在下直接制备二甲醚(CH3OCH3)。
己知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
CO(g)+H2O(g) △H2=+41.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1
(1)工业上用CO2和H2在一定条件下反应直接制备二甲醚,主反应为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①要使该反应速率和产率都增大,应该采取的措施是__________;若想减少副反应,大幅度提高二甲醚在产物中所占比率的关键因素是__________。
②一定条件下.上述主反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是__________(填标号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的 变小
变小
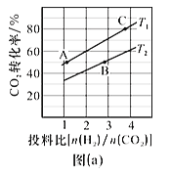
③在某压强下,制备二甲醚的反应在不同温度、不同投料比时CO2的转化率如图(a)所示。T1温度下,将6molCO2和12molH2充入10L的密闭容器中, 5 min后反应达到平衡状态,则0〜5 min内的平均反应速率v(CH3OCH3)=__________;KA、 KB、 KC三者之间的大小关系为___________。
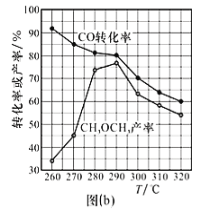
(2)在适当条件下由CO和H2直接制备二甲醚,另一产物为水蒸气。
①该反应的热化学方程式是_______________________________。
②CO的转化率、二甲醚的产率与反应温度的关系如图(b)所示,请解释290℃后升高温度,CH3OCH3产率逐渐走低的原因可能是________________________________。
-
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1。一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中正确的是
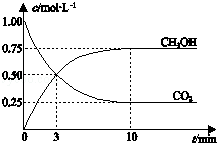
A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
-
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ·mol﹣1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
CH3OH(g)+H2O(g)△H=﹣49.0kJ·mol﹣1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示,下列叙述中正确的是
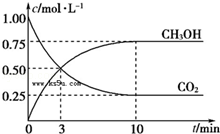
A.欲增大平衡状态时c(CH3OH)/c(CO2)的比值, 可采用 升高温度的方法
B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能减小反应容器的体积
D.从反应开始到平衡,CO2的平均反应速率v(CO2)=0.025 mol·L﹣1·min﹣1
-
已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ•mol﹣1.一定条件下,向体积为1L的密闭容器中充入1molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示.下列叙述中正确的是
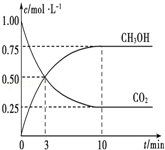
A.欲增大平衡状态时 的比值,可采用升高温度的方法
的比值,可采用升高温度的方法
B.达到平衡状态时,CO2的平衡转化率为75%
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol•L﹣1•min﹣1
-
已知:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH=-49.0 kJ﹒mol-1。一定条件下,向体积为1 L的密闭容器中充入1 molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g)+ H2O(g) ΔH=-49.0 kJ﹒mol-1。一定条件下,向体积为1 L的密闭容器中充入1 molCO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
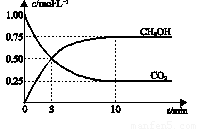
A.10min后,升高温度能使 增大
增大
B.3 min时,CO2的消耗速率等于用CH3OH生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol﹒L-1﹒min-1
-
已知:CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )
CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是 ( )

A. 升高温度能使 增大
增大
B. 反应达到平衡状态时,CO2的平衡转化率为75%
C. 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D. 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
-
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如右图所示。下列叙述中,正确的是

A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
-
已知:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH =-49.0 kJ•mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是

A.升高温度能使 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1
 CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1 CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1 CH3OH(g) ΔH1,则ΔH1=___kJ•mol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJ•mol-1,该反应自发进行的条件为___ CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。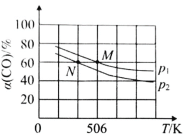
 CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:







