-
硫酸厂尾气中含有大量SO2,回收并综合利用SO2对环境保护有重要意义。
(1)利用氨水吸收烟气中的SO2可转化为(NH4)2SO4。相关反应的主要热化学方程式如下:
SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(l) ΔH2=bkJ•mol-1
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=ckJ•mol-1
①反应2SO2(g)+4NH3•H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O(l)的ΔH=________kJ•mol-1
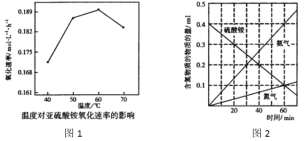
②空气氧化NH4HSO3的速率随温度的变化如图1所示,当温度超过60℃时,(NH4)2SO3氧化速率下降的原因可能是________。研究发现,在500℃下硫酸铵分解过程中得到4种产物,其含氮物质随时间变化关系如图2所示。写出该条件下硫酸铵分解的化学方程式:____________。
(2)工业上利用SO2尾气可制备亚硫酰氯(SOCl2)。SOCl2是一种发烟液体,易水解,可用于农药、医药、染料、电池等生产,其制备原理为:S(s)+2Cl2(g)+SO2(g)⇌2SOCl2(g)。
①该反应的平衡常数表达式为____。
②用SOCl2与A1Cl3•6H2O混合共热,可得到无水A1Cl3,原因是________。
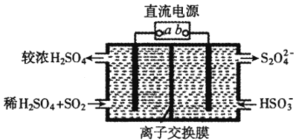
(3)用电解法处理含有SO2尾气的装置如图所示(电极材料均为惰性电极)。该装置中的离子交换膜为___离子交换膜(填“阴”或“阳”);阴极的电极反应式为__。
-
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
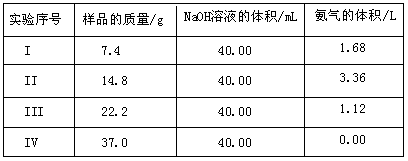
(1)实验过程中有关反应的离子方程式为________
________;
(2)由I组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为
L;
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比________;
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度为________。
-
(本题共14分)火力发电厂产生的烟气中含有CO2、CO、SO2等物质,直接排放会对环境造成危害。对烟气中CO2、CO、SO2等物质进行回收利用意义重大。
(1)“湿式吸收法”利用吸收剂与烟气中的SO2发生反应从而脱硫,其中“钠碱法”用NaOH溶液作吸收剂,向100mL2mol·L-1的NaOH溶液中通入标准状况下4.48LSO2气体,反应后测得溶液pH<7.则溶液中下列各离子浓度关系正确的是 (填字母序号).
a.c(HSO3-)>c(SO32-)>c(H2SO3)
b.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)
c.c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-)
d.c(H+)= c(SO32-)- c(H2SO3)+c(OH-)
(2)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示

①在阳极区发生的反应中的非氧化还原反应的离子方程式为 .
②简述CO32-在阴极区再生的原理 .
(3)下表中列出了25℃、l0l kPa时一些物质的燃烧热数据:

已知键能:C—H键:413.4kJ.mol-l. H—H键:436.0 kJ·mol-1,请计算:
①2CH4(g)=C2H2(g)+3H2(g) △H=
②C2H2中—C≡C—的键能为 kJ·mol-l
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。负极反应式为 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,为此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
-
治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.硫酸厂大量排放含SO2的尾气会对环境造成严重危害。
(1)工业上可利用废碱液(主要成分为Na2CO3)处理硫酸厂尾气中的SO2,得到Na2SO3溶液,该反应的离子方程式为______。
Ⅱ.沥青混凝土可作为反应;2CO(g)+O2(g)⇌2CO2(g)的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
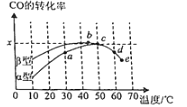
(2)a、b、c、d四点中,达到平衡状态的是______。
(3)已知c点时容器中O2浓度为0.02mol•L-1,则50℃时,在α型沥青混凝土中CO转化反应的平衡常数K=______(用含x的代数式表示)。
(4)观察分析图,回答下列问题:

①CO转化反应的平衡常数K(a)______K(c)。
②在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率比α型要______(填“大”、“小”)。
③______点时CO与O2分子之间发生有效碰撞的几率在整个实验过程中最高。
-
“绿色化学”要求从技术上、经济上设计可行的化学反应,使其尽可能减少对环境的负作用。下列化学反应中,不符合绿色化学概念的是
A. 用氨水吸收硫酸厂的尾气:SO2+2NH3+H2O=(NH4)2SO3
B. 除去硝酸工业尾气中的氮氧化合物:NO2+NO+2NaOH=2NaNO2+H2O
C. 制硫酸铜:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. 制硫酸铜:2Cu+O2 2CuO , CuO+H2SO4(稀)=CuSO4+H2O
2CuO , CuO+H2SO4(稀)=CuSO4+H2O
-
SO2是空气污染物 ,含有SO2 的尾气需处理后才能排放,有多种方法可除 去尾气中SO2。回答下列问题:
(1)氨水吸收法。利用氨水吸收烟气中的SO2, 其相关反应的主要热化学方程式如下:
SO2(g)+NH 3 • H2O(aq)=NH4HSO3(aq) △H1=akJ•mol-1;
NH 3 • H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(aq)+H2O(1)△H2= b kJ• mol-1;
2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4 (aq)△H3 =ckJ• mol-1;
则反应 2SO2(g)+4 NH 3 • H2O(aq)+ O2(g)=2(NH4)2SO4(aq)+2H2O(l)的△H=___________kJ• mol-1(用含a、b、c的代数式表示)。
(2)热解气还原法。已知CO与SO2 在加热和催化剂作用 下生成生成S(g)和CO2。
①该反应的化学方程式为__________。
②在T °C时,向lL恒容的密闭容器中入充1 mol CO、0.5molSO2发生上述反应(S为气态).5min时达到化学平衡,平衡时测得SO2的转化率为90 %,则 0 ~ 5 mi n 内 反应的平均速率v(SO2)=__________。此温度下该反应的平衡常数 K1=_______。下列选项中能够说明该反应已经达到平衡状态的是_____(填字母)。
a.体系的压强保持不变
b.混合气体的密度保持不变
c.混合气体的平均摩尔质量保持不变
d.单位时间内CO消耗的物质的量与 SO2 生成的物质的量之比为2:1
(3)氧化锌吸收法。配制ZnO悬浊液(含少量 MgO、CaO)在吸收塔中封闭循环脱硫。发生的主要反应为ZnO十SO2 = ZnSO3(s).吸收过程中,测得pH、吸收效率η随 时间t的变化如图a所示。溶液中含硫元素微粒各组分浓度之比如图b所示。

①已知纯ZnO的悬浮液 pH 约为6.8,判断在pH-t曲线cd 段发生的主要反应的离子方程式为____________。
②SO2的吸收效率η随 pH 降低而减小的原因是____________。
-
下列关于资源综合利用和环境保护中涉及的化学方程式不正确的是( )
A. 海水提溴时用SO2吸收Br2蒸气:SO2+Br2+2H2O===2HBr+H2SO4
B. 将煤气化为可燃性气体:C(s)+H2O(g)  CO(g)+H2(g)
CO(g)+H2(g)
C. 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH===NaHSO3
D. 燃煤中加入石灰石脱硫:2CaCO3+2SO2+O2 2CaSO4+2CO2
2CaSO4+2CO2
-
研究燃煤烟气的脱硫(除SO2)和脱硝(除NOx)具有重要意义,请回答下列问题。
(1)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。已知常温下,该溶液的pH=5,则 =_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,
=_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体, 的值将________(填“变大”、“不变”或“变小”)。
的值将________(填“变大”、“不变”或“变小”)。
(2)用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示。
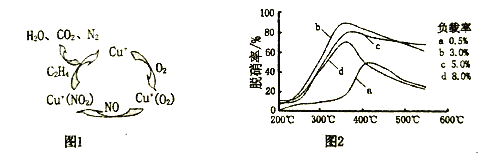
①写出该脱硝过程中乙烯和NO2反应的化学方程式:___________________。
②要达到最佳脱硝效果,应采取的条件是:___________________。
(3)利用如图装置可实现用Na2SO4溶液吸收SO2,再用离子膜电解法电解吸收液得到单质硫。

①a端应连接电源的_____(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,其目的是_______________。
③电解过程中,阴极的电极反应式为______________。
-
“绿水青山就是金山银山”,因此研究NOx,SO2等大气污染物的妥善处理具有重要意义。
SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)=NH4HSO3(aq) △H1=akJ/mo1;
②NH3·H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) △H2=b kJ/mo1;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) △H3=c kJ/mo1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)=2(NH4)2SO4(aq)+2H2O △H
(1)△H =______kJ/mo1 (用含a、b、c的代数式表示)。
(2)对于反应:C(s)+2NO(g) N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H =-34.0kJ/mol,在T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①0~10min内,CO2的平均反应速度v(CO2)=________。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是_______(填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
(3)用活性炭还原法处理NO,有关反应为:C(s)+2NO(g) N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:
N2(g)+CO2(g) △H =-34.0kJ/mo1。已知在一体积不变的密闭容器中,加入足量的C和一定量的NO气体,测得NO的转化率随温度的变化如下图所示:
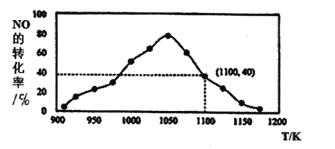
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________;
②在1100K时,CO2的体积分数为________。
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H =-746.8 kJ/mo1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2) (k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”) k逆增大的倍数。
②若在2L的密闭容器中充入2molCO和2molNO,在一定温度下达到平衡时,CO的转化率为50%,则 _______。
_______。
-
石嘴山市打造“山水园林城市”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。
已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)= NH4HSO3(aq) ΔH1=a kJ/mol;
②NH3·H2O(aq)+ NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=b kJ/mol;
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH3=c kJ/mol。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g) =2(NH4)2SO4(aq)+2H2O(l)的ΔH=______kJ/mol。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
2CaSO4(s)+2CO2(g) ΔH =−681.8 kJ/mol对煤进行脱硫处理来减少SO2的排放。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间/min 浓度/mol·L−1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10 min内,平均反应速率v(SO2)=_____mol/(L·min)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是_____(填字母)。
A.通入一定量的O2 B.加入一定量的粉状碳酸钙
C.适当缩小容器的体积 D.加入合适的催化剂
(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g) N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) ΔH=−34.0 kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
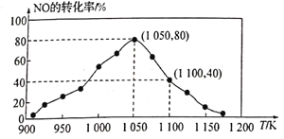
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为______。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106 Pa时,该反应的化学平衡常数Kp=____[已知:气体分压(P分)=气体总压(P)×体积分数]。
(5)汽车尾气还可利用反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) ΔH=−746.8 kJ/mol,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆=_____。










