-
[化学—选修2:化学与技术]
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
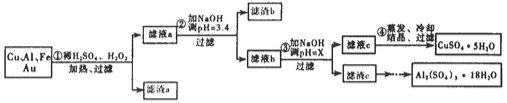
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
-
[化学选修2——化学与技术](15分)
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组,将一批废弃的线路析简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的所有的离子方程式为_______;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是___________,使用H2O2的优点是___________,调溶液pH的目的是使________________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
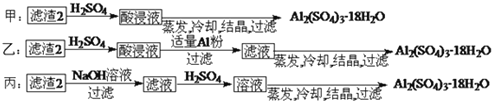
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
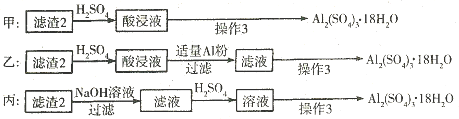
上述三种方案中,________方案不可行,原因是________________从原子利用率角度考虑,__________方案更合理。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
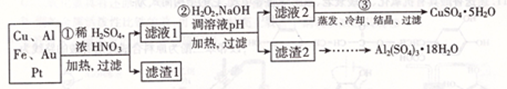
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 | Fe( OH)2 | Fe( OH)3 | Al( OH)3 | Cu( OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是________;
(2)某学生认为用H2O2代替浓HNO3更好,理由是;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是________。
(3)第②步中应将溶液pH调至________。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:
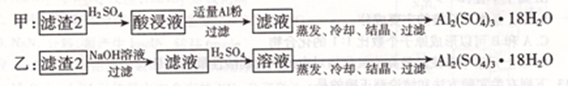
你认为________种方案为最佳方案,理由是________、________。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2 2S2O +I2= 2I-+S4O
+I2= 2I-+S4O
①样品中硫酸铜晶体的质量分数为____________。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某化学兴趣小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出利用此金属混合物制备硫酸铜和硫酸铝晶体的路线:
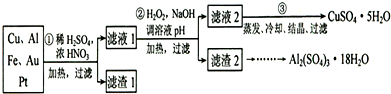
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为______ Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀 和
和 混合液的离子方程式:________。
混合液的离子方程式:________。
(2)检验X中阳离子的方法和现象是________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:________、________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 ________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
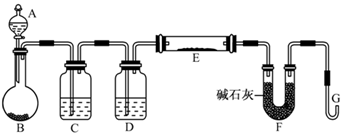
①仪器B中应装入________,装置D的作用________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
________在这两步之间还应进行的操作是________;
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,将得到的红色金属M和金属E进行如下框图所示转化,获得高效净水剂K2EO4.(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式________ 。
(2)检验X中阳离子的方法和现象是________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。试用离子方程式表示溶液变为蓝色的原因:________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、烧杯、玻璃棒、漏斗、铁架台外,还需要用到的硅酸盐仪器有________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图。A中试剂是盐酸。

①装置D的作用________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体”? ________在这两步之间还应进行的操作是________ 。
③该实验设计是否还有不足之处?若有请指出并改进,如没有本问可不答。
(6)试说明K2EO4可用作高效净水剂的原因________。
-
[2012·天津卷](14分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
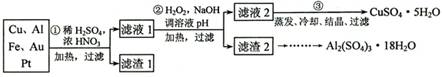
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
________;调溶液pH的目的是使________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
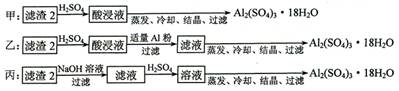
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
-
信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 、
、 、
、 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
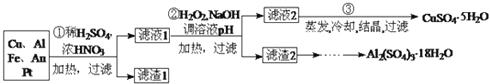
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第
第 步加入
步加入 的作用是 ______ ,使用
的作用是 ______ ,使用 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:
上述三种方案中, ______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c 
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式 ______ .
______ .
-
信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 、
、 、
、 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
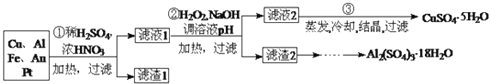
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第
第 步加入
步加入 的作用是 ______ ,使用
的作用是 ______ ,使用 的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:

上述三种方案中, ______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取 ,消除干扰离子后,用c
,消除干扰离子后,用c 
 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算 质量分数的表达式
质量分数的表达式 ______ .
______ .
-
(12分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
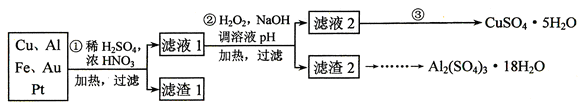
请回答下列问题:
⑴ 第①步Cu与混酸反应的离子方程式为_________ _____________________;
得到滤渣1的主要成分为_________ _____ _____。
⑵ 第②步加H2O2的作用是_________ ____________,使用H2O2的优点是____ _____;调溶液pH的目的是使____________ ___________________生成沉淀。
⑶ 简述第③步由滤液2得到CuSO4·5H2O的方法是________ ________________ 。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,_______ __________方案不可行,原因是_________ ________________:
从原子利用率角度考虑,_____ ______方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ___________ __________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是____ _________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子


















