-
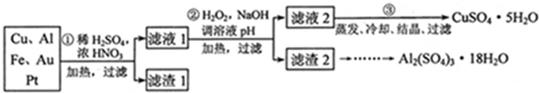
[2012·天津卷](14分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
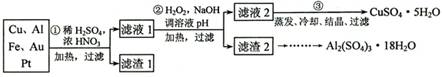
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是
________;调溶液pH的目的是使________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
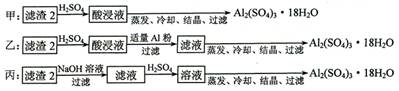
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
-
[化学选修2——化学与技术](15分)
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组,将一批废弃的线路析简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的所有的离子方程式为_______;得到滤渣1的主要成分为___________。
(2)第②步加H2O2的作用是___________,使用H2O2的优点是___________,调溶液pH的目的是使________________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_______________________。
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
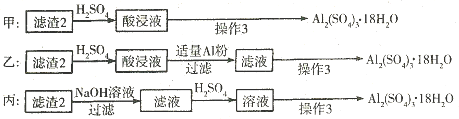
上述三种方案中,________方案不可行,原因是________________从原子利用率角度考虑,__________方案更合理。
-
(12分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
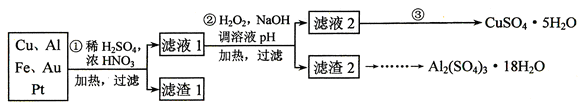
请回答下列问题:
⑴ 第①步Cu与混酸反应的离子方程式为_________ _____________________;
得到滤渣1的主要成分为_________ _____ _____。
⑵ 第②步加H2O2的作用是_________ ____________,使用H2O2的优点是____ _____;调溶液pH的目的是使____________ ___________________生成沉淀。
⑶ 简述第③步由滤液2得到CuSO4·5H2O的方法是________ ________________ 。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:

上述三种方案中,_______ __________方案不可行,原因是_________ ________________:
从原子利用率角度考虑,_____ ______方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= ___________ __________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是____ _________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
-
(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
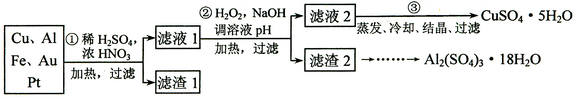
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是___________________________________________,使用H2O2的优点是________________________;调溶液pH的目的是使__________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是_____________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
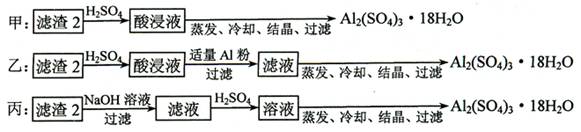
上述三种方案中,_________________方案不可行,原因是_____________________________;
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2+ + H2Y2- = CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
-
(16分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
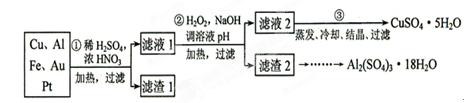
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为_______________________________;得到滤渣1的主要成分为___________________。
(2)第②步加H2O2的作用是________________,使用H2O2的优点是________
________;调溶液pH的目的是使________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
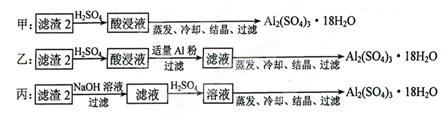
上述三种方案中,_______方案不可行,原因是_____________________________;从原子利用率角度考虑,________方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4·5H2O质量分数的表达式w= ________________ ;下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
-
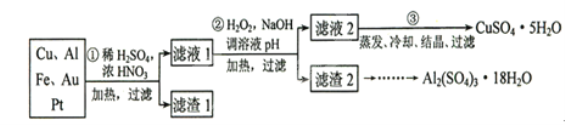
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如图1制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为________;
得到滤渣1的主要成分为________.
(2)第②步加H2O2的作用是________,使用H2O2的优点是________;调溶液pH的目的是使________生成沉淀.
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是________.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案: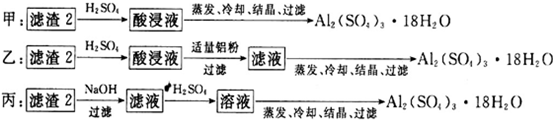
上述三种方案中,________方案不可行,原因是________:从原子利用率角度考虑,________方案更合理.
(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4•5H2O质量分数的表达式ω=________;
下列操作会导致CuSO4•5H2O含量的测定结果偏高的是________.
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子.
-
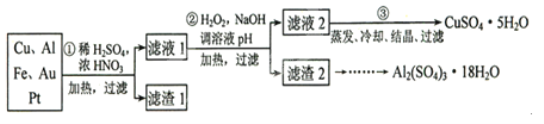
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为___________________________;得到滤渣1的主要成分为__________________________.
(2)第②步加H2O2的作用是_______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________。
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_____________________
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu,25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:(友情提示:要将溶液中的 、
、 、
、 、
、 沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
沉淀为氢氧化物,需溶液的pH分别为:6.4、6.4、3.7、4.7)
请回答下列问题:
(1)如何检验滤液1中是否含有 ?_______________;得到滤渣1的主要成分为____________。
?_______________;得到滤渣1的主要成分为____________。
(2)第2步加 的作用是____________,使用
的作用是____________,使用 的优点是____________;调溶液pH的目的是使____________生成沉淀。
的优点是____________;调溶液pH的目的是使____________生成沉淀。
(3)用第③步所得 制备无水
制备无水 的方法是____________。
的方法是____________。
(4)由滤渣2制取 ,探究小组设计了三种方案:
,探究小组设计了三种方案:
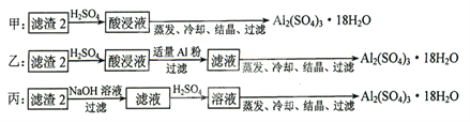
上述三种方案中,______方案不可行,原因是_________;从原子利用率角度考虑,______方案更合理。
(5)结晶水的测定:将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至250℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量。请纠正实验过程中的两处错误:______________、______________。
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如图1制备硫酸铜和硫酸铝晶体的路线:

请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为________;
得到滤渣1的主要成分为________.
(2)第②步加H2O2的作用是________,使用H2O2的优点是________;调溶液pH的目的是使________生成沉淀.
(3)用第③步所得CuSO4•5H2O制备无水CuSO4的方法是________.
(4)由滤渣2制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
上述三种方案中,________方案不可行,原因是________:从原子利用率角度考虑,________方案更合理.
(5)探究小组用滴定法测定CuSO4•5H2O (Mr=250)含量.取a g试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用c mol•L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL.滴定反应如下:Cu2++H2Y2-=CuY2-+2H+
写出计算CuSO4•5H2O质量分数的表达式ω=________;
下列操作会导致CuSO4•5H2O含量的测定结果偏高的是________.
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子.
-
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):

(1)写出M溶于稀 和
和 混合液的离子方程式:________。
混合液的离子方程式:________。
(2)检验X中阳离子的方法和现象是________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:________、________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 ________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
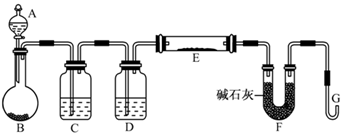
①仪器B中应装入________,装置D的作用________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
________在这两步之间还应进行的操作是________;


















