-
(16分)黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
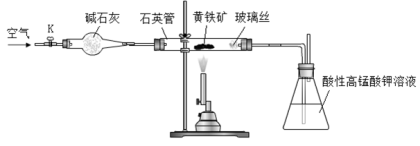
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2 2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 。(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择下图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。
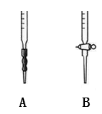
(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 。(保留到小数点后1位)
-
黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应)。某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数。
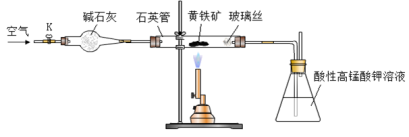
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100 mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00 mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次。
已知:4FeS2+11O2 2Fe2O3+8SO2;
2Fe2O3+8SO2;
2KMnO4+5SO2+2H2O K2SO4+2MnSO4+2H2SO4
K2SO4+2MnSO4+2H2SO4
请回答下列问题:
(1)连接好装置,检查装置气密性的操作是 。
(2)通入空气的作用是 。
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数 (填“偏高”、“偏低”或“不变”)。
(4)滴定时,应选择图中的 (填字母序号)盛装标准H2C2O4溶液,根据 现象来判断滴定已经达到终点。

(5)滴定过程中发生反应的离子方程式是 。
(6)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是 (保留到小数点后1位)。
-
黄铁矿是工业上制取硫酸的主要原料,其主要成分为FeS2,含少量杂质(杂质不含S元素,且高温下不反应).某化学兴趣小组用下列装置测定黄铁矿中硫元素的质量分数.
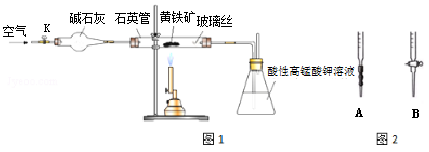
称取2.0g研细的黄铁矿样品,将样品放入石英管中,缓慢鼓入空气,再加热石英管至800~850℃;锥形瓶中盛装100mL 0.2mol/L酸性KMnO4溶液用于吸收SO2(忽略SO2、H2SO3与氧气反应);反应结束后,每次从锥形瓶中取出25.00mL溶液,用0.23mol/L标准H2C2O4溶液滴定,重复三次.已知:4FeS2+11O2 2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4请回答下列问题:
2Fe2O3+8SO2;2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4请回答下列问题:
(1)连接好装置,检查装置气密性的操作是___________________
(2)通入空气的作用是_________________________.
(3)若实验过程中鼓入空气的速率过快,则测得的硫元素的质量分数__________.(填“偏高”、“偏低”或“不变”)
(4)滴定时,应选择右图中的_________(填字母序号)盛装标准H2C2O4溶液,根据_____________现象来判断滴定已经达到终点.
(5)如果黄铁矿中的硫全部转化为SO2,且被酸性KMnO4溶液完全吸收,滴定操作中,平均耗用0.23mol/L标准H2C2O4溶液21.73mL,则黄铁矿样品中硫元素的质量分数是____________.(保留到小数点后1位)
-
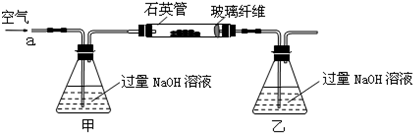
(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。
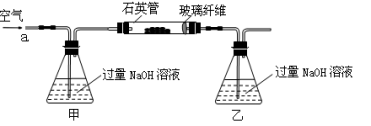
其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
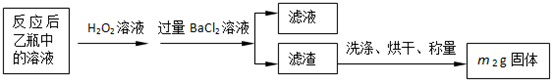
反应结束后,将乙瓶中的溶液进行如下处理:
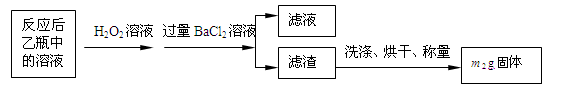
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】测定铁元素的含量
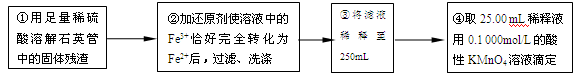
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
-
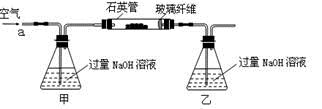
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
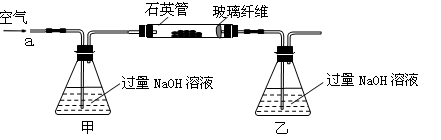
将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2,4FeS + 7O2
2Fe2O3+8SO2,4FeS + 7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
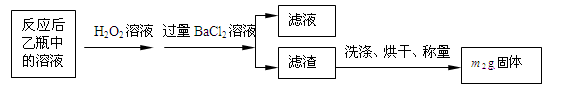
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________________________________________________________。H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为 (列出表达式即可)。
【实验二】:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量____________(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
-
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
4FeS2+11O2 2Fe2O3+8SO2 4FeS+7O2
2Fe2O3+8SO2 4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】:测定硫元素的含量反应结束后,将乙瓶中的溶液进行如下处理:
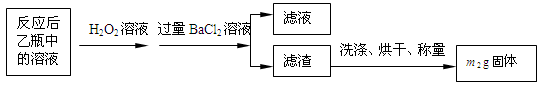
(1)鼓入空气的作用是__________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是_______________(用化学方程式表示)。
H2O2可以看作是一种很弱的酸,写出其电离方程式: 。
(3)该黄铁矿石中硫元素的质量分数为__________(列出表达式即可)。
【实验二】:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =___________。
-
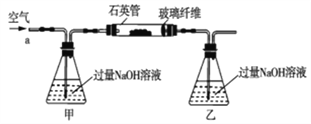
黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
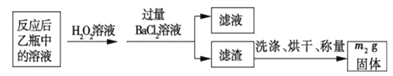
(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方 程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出 表达式即可)。
(实验二)测定铁元素的含量
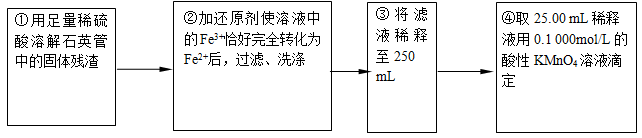
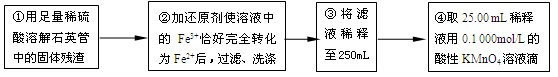
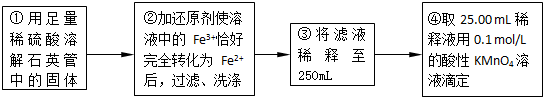
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
-
黄铁矿石的主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化),它是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
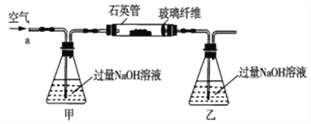
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(1)鼓入空气的作用是_____________________。
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方 程式表示)。H2O2可以看成是一种很弱的酸,写出其主要的电离方程式为____________________。
(3)该黄铁砂石中硫元素的质量分数为____________________(列出 表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤 ③将过滤液稀释至250mL
④取25.00 mL稀释液,用0.100 mol·L-1的酸性KMnO4溶液滴定
(4)步骤②中,若用铁粉作还原剂,则所测得的铁元素的含量__________(填“偏大”“ 偏小” 或“无影响”)。
(5)请写出步骤②中洗涤的方法____________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 第一次 | 第二次 | 第三次 | 第四次 |
| 消耗KMnO4溶液体积/ml | 25.00 | 25.03 | 20.00 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度c(Fe2+)=__________。
-
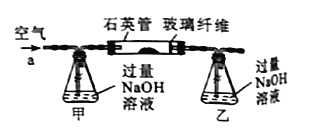
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.其反应的化学方程式为:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
实验一:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是______、______;
乙瓶内发生反应的离子方程式为______、______;
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是______.
(3)该黄铁矿石中硫元素的质量分数为______.
实验二:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______.
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=______.
-
黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
(1)鼓人空气的作用是___________,锥形瓶乙中NaOH溶液的作用是___________。
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
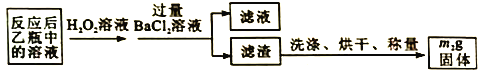
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。
(3)洗涤滤渣的方法是______________________。
(4)该黄铁矿石中硫元素的质量分数为___________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________(填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________。

2Fe2O3+8SO2;
K2SO4+2MnSO4+2H2SO4





















