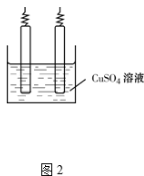-
(14分)铜在自然界存在于多种矿石中.
(Ⅰ)以硅孔雀石(主要成 分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
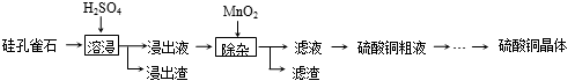
已知:Fe3+、Cu2+和Fe2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、6.7和9.7.
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生反应的化学方程式 .
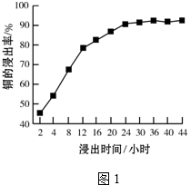
(2)“溶浸”中,选取浓度为20% H2SO4为浸出剂,铜的浸出率与浸出时间的关系见图1.由图1可得,随着浸出时间的增长, (至少写一条变化规律).
(3)“除杂”中,加入MnO2的作用是 (用离子方程式表示).“除杂”中需在搅拌下加入石灰乳以调节溶液的pH到3~4,沉淀部分杂质离子,分离得滤液.滤渣的主要成分为 .
(Ⅱ)以黄铜矿(主要成分为CuFeS2)为原料炼制精铜的工艺流程如下:
黄铜矿 精铜冰铜(Cu2S和FeS)
精铜冰铜(Cu2S和FeS) 粗铜
粗铜 精铜
精铜
(4)“还原”工艺中其中一个反应为:Cu2S+2Cu2O  6Cu+SO2↑,该反应的氧化剂是 .
6Cu+SO2↑,该反应的氧化剂是 .
(5)粗铜含少量Fe、Ag、Au等金属杂质,电解精炼铜时,阴极反应式为 .完成图2中由粗铜电解得到精铜 的示意图,并作相应标注.
的示意图,并作相应标注.
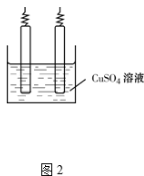
-
以硅孔雀石[主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O, 含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O SO2↑+2HCl↑
SO2↑+2HCl↑
(1) “酸浸”时盐酸与 CuCO3·Cu(OH)2 反应的化学方程式为 ________________。 为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③______________。
(2) “氧化”时发生反应的离子方程式为__________________。
(3) “滤渣 2”的主要成分为_______(填化学式);“调pH”时,pH 不能过高,其原因是___________。
(4) “加热脱水”时, 加入 SOCl2的目的是_____________________________________。
-
以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
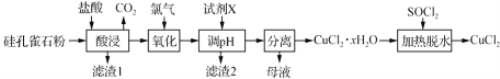
已知: SOCl2+H2O SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+ 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
-
以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
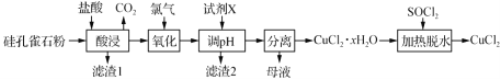
已知: SOCl2+H2O SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+ 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
-
以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+ 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
-
以孔雀石(主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
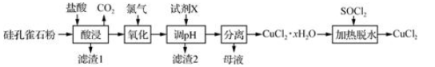
SOCl2+H2O SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为 。为提高“酸浸”时铜元素的浸出率,可以采取的措施有:①适当提高盐酸浓度;②适当提高反应温度;③ 。
(2)“氧化”时发生反应的离子方程式为 。
(3)“滤渣2”的主要成分为 (填化学式);“调pH”时,pH不能过高,其原因是 。
(4)“加热脱水”时,加入SOCl2的目的是 。
-
(15分)硅孔雀石的主要成分为CuCO3•Cu(OH)2和CuSiO3•2H2O,还含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下:

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
请回答下列问题:
(1)滤渣B的主要成分是 (用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由 。
(2)用离子方程式表示加入绿色氧化剂A的作用 。
(3)可向滤液A中加入 (填字母)调节PH以除去杂质
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括 、用乙醇洗涤、用滤纸吸干等。
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是 填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为 。
-
(16分)硅孔雀石是一种含铜的矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下:
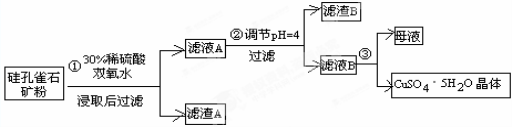
(1)步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式: ;
用离子方程式表示双氧水的作用_______________________________________。
(2)步骤②调节溶液pH选用试剂不可以是__________________
a.CuO b.Cu (OH)2 c.Cu2(OH)2CO3 d.CuSO4
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知当溶液pH=4时,可以完全除去的离子是______(填金属离子符号,后同),不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶、洗涤可以得到CuSO4•5H2O晶体。某同学认为上述操作会有硫酸铝晶体析出。请你结合相关数据,通过计算对该同学的观点予以评价 (填“正确”、“不正确”、或“无法判断”)
【已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol/L,Ksp[Al(OH)3]=3.2×10-34】
(5)测定硫酸铜晶体(CuSO4•5H2O)里结晶水的含量,实验步骤为:a.研磨;b.称量空坩埚和装有试样的坩埚的质量;c.灼烧;d.干燥器中冷却;e.称量;f.重复c至e的操作,直到连续两次称量的质量差不超过0.1g为止;⑦根据实验数据计算硫酸铜结晶水的含量。
①步骤c用到的仪器有酒精灯、三脚架、泥三角、玻璃棒、 、 。
②步骤f的目的是 。
③如灼烧后在空气中冷却再称量,结晶水的测定结果会____(填“偏高”、“低”或“不变”)
-
(12分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3、Cu(OH)2和CuSiO3∙2H2O,同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质。以其为原料制取硫酸铜的工艺流程如下图所示:
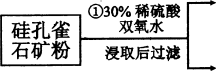
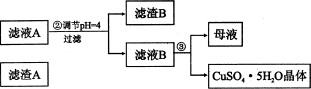
(1)步骤1中先加入足量稀硫酸,再加人双氧水。则双氧水参与该反应的离子方程式是_________________。
(2)步骤②调节溶液pH,可以选用的试剂是________。(填字母编号)
A.A12O3 B.CuO C.CuCO3·Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
则滤液B中含有的阳离子是__________________________。
(4)将滤液B通过_______、________、过滤等操作可得到硫酸铜晶体。
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是______________。取384g CuS在一定条件下和氧气完全反应,若发生2CuS+3O2=2CuO+2SO2和4CuS+5O2=2Cu2O+4SO2两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为bmol。则a=__________。(氧气占空气体积的五分之一)
-
(16分) 硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
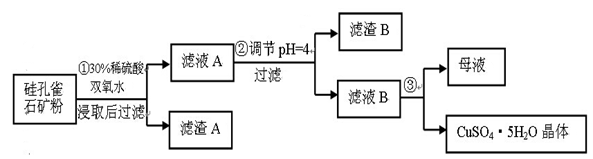
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____ 。
(2)步骤②调节溶液pH,可以选用的试剂是______。
A. CuO B.Fe2O3 C.Al2O3 D.Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为 ,滤液B中除Cu2+外, 还含有的金属阳离子是 。
(4)将滤液B通过 、 ,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
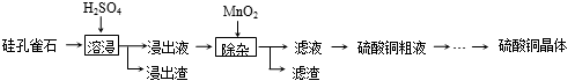

精铜冰铜(Cu2S和FeS)
粗铜
精铜
6Cu+SO2↑,该反应的氧化剂是 .
的示意图,并作相应标注.